

| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中. | / |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | 过量的稀盐酸; 通入装少量品红溶液的试管 | 若品红褪色则固体中含有Na2SO3,若品红不褪色则固体中不含有Na2SO3; |
| ③ | 取②充分反应后的溶液于试管中,滴入适量BaCl2溶液 | 若有白色沉淀生成则固体中含有Na2SO4 ,若没有白色沉淀生成则固体中不含有Na2SO4; |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
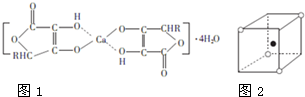 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑦ | ? | ||||||
| 三 | ① | ③ | ⑤ | ⑥ | ⑧ | ⑩ | ||
| 四 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com