
【题目】下列图示中实验基本操作正确的是( )
A  B
B  C
C 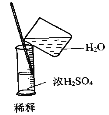 D
D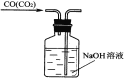
A. 除去CO的CO2 B. 萃取时振荡混合液 C. 稀释浓硫酸 D. 向试管中滴加液
【答案】B
【解析】
A. 向试管中滴加液体,胶头滴管应垂直悬空,不能插入到试管中;
B.萃取时振荡混合液,应用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,使两种液体充分接触,振荡后打开活塞,将漏斗内气体放出;
C. 量筒只能用来量取液体的体积,据此分析;
D. 洗气的原则是“长进短出”,据此分析;
A、使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误,故A错误;
B、萃取震荡时,用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来震荡,使两液体充分接触,故B正确;
C、量筒只能用来量取液体的体积,不能用来配制溶液或稀释操作,故C错误;
D、洗气的原则是“长进短出”,图中是短进长出,故D错误;
正确选项B。


科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
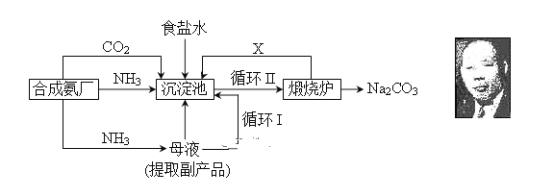
(1) 上述生产纯碱的方法称________________,副产品的一种用途为____________。
(2) 沉淀池中发生的化学反应方程式是____________________________________。
(3) 写出上述流程中X物质的分子式________________。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________________________________________________________。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A. 氧化→吸收→吹出B. 氧化→吹出→吸收
C. 吹出→氧化→吸收D. 吹出→吸收→氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
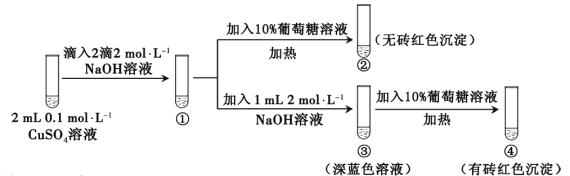
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com