
| �¶�/��\CO���������%\Ͷ�ϱ� | $\frac{n��{H}_{2}O��}{n��CO��}$=1 | $\frac{n��{H}_{2}O��}{n��CO��}$=3 | $\frac{n��{H}_{2}O��}{n��CO��}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
���� ��1�����ݷ�Ӧ����v=$\frac{��c}{��t}$�����������̼�ķ�Ӧ���ʣ���������ʽ������ﵽƽ��ʱ����ֵ�Ũ�ȣ����ݸ���K=$\frac{c��C{O}_{2}��c��{H}_{2}��}{c��CO��c��{H}_{2}O��}$�����ƽ�ⳣ����
��2�������ÿ��Ʊ����������ݱ��������ж��¶ȡ���Ӧ��Ͷ�ϱȶ�CO�����������Ӱ��������ɱ������ݿ�֪���¶�һ��ʱ����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$Խ��ƽ��ʱCO���������ԽС��CO��ת����Խ��
���ɱ������ݿ�֪���¶�һ��ʱ����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$Խ��ƽ��ʱCO���������ԽС��CO��ת����Խ��Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$һ��ʱ���¶�Խ�ͣ�ƽ��ʱCO���������ԽС��CO��ת����Խ�ߣ����Խ����¶ȣ�����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$��ԭ������ˮ�����ı�����
������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��
�ܴӷ�Ӧ���ʡ�ƽ���ƶ��Ƚ��з�����𣬾�������¶ȣ�����߷�Ӧ���ʣ���ƽ�������ƶ���CO��ת�����½���ʵ������������Ӧ���ۺϿ������ʺ�ƽ���������棻
��� �⣺��1����ø÷�Ӧʵ�ʷų�������Ϊ20.5kJ����Ӧ���ĵ�CO�����ʵ���Ϊ��n��CO��=$\frac{20.5KJ}{41KJ/mol}$=0.5mol��
��������ʽ���ɵã�
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��1mol 3mol 0 0
ת����0.5mol 0.5mol 0.5mol 0.5mol
ƽ�� 0.5mol 2.5mol 0.5mol 0.5mol
��ʱ�䷶Χ�ڷ�Ӧ��ƽ�����ʦ� ��CO ��=$\frac{\frac{0.5mol}{1L}}{5min}$=0.1 mol•L-1•min-1��
���¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ��K=$\frac{c��C{O}_{2}��c��{H}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{\frac{0.5}{1}��\frac{0.5}{1}}{\frac{0.5}{1}��\frac{2.5}{1}}$=0.2��
�ʴ�Ϊ��0.1 mol/��L•min����0.2��
��2�����ɱ������ݿ�֪���¶�һ��ʱ����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$Խ��ƽ��ʱCO���������ԽС��CO��ת����Խ��ƽ����������CO���������Խ����CO��ƽ��ת����ԽС��
�ʴ�Ϊ��С��
���ɱ������ݿ�֪���¶�һ��ʱ����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$Խ��ƽ��ʱCO���������ԽС��CO��ת����Խ�����ϱ��е����ݷ�������������Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$һ��ʱ���¶�Խ�ͣ�ƽ��ʱCO���������ԽС��CO��ת����Խ�ߣ����Խ����¶ȣ�����Ӧ��Ͷ�ϱ�$\frac{n��{H}_{2}O��}{n��CO��}$��ԭ������ˮ�����ı�������������CO��ת���ʣ�
�ʴ�Ϊ��������������¶ȣ�
��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.0kJ/mol����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У�ƽ�ⳣ����С������K��300�棩��K��200�棩��
�ʴ�Ϊ������
�ܾ�������¶ȣ�����߷�Ӧ���ʣ���ƽ�������ƶ���CO��ת�����½���ʵ������������Ӧ���ۺϿ������ʺ�ƽ���������棬ѡ������¶�Ϊ300�棬
�ʴ�Ϊ������¶ȣ�����߷�Ӧ���ʣ���ƽ�������ƶ���CO��ת�����½���ʵ������������Ӧ���ۺϿ������ʺ�ƽ���������棻
���� ���⿼�黯ѧƽ����㡢��ѧƽ�ⳣ�����㡢��ѧ��Ӧ�����뻯ѧƽ��Ӱ�����صȣ���Ŀ�Ѷ��еȣ��ϺõĿ�����ѧ���ķ������������������Ӧ����ѧ֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X�Ļ�ѧʽΪAgS | |
| B�� | �����鶾ʱ����������������������Ӧ | |
| C�� | ��Ӧ��Ag��H2S���ǻ�ԭ�� | |
| D�� | ÿ����1mo1X��ת��2mo1���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ�ȣ�mol/L�� | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��2mL 2%CuSO4��Һ�м���0.5mL 1%��NaOH��Һ����μ�M��Һ������ | δ����ש��ɫ���� | M�в���ȩ�� |
| B | ��CuSO4��Һ�н���KI��Һ���ټ��뱽������ | �а�ɫ�������ɣ�������Ϻ�ɫ | ��ɫ��������ΪCuI |
| C | ���л��Լ�N�м���2mL5%��NaOH��Һ�����ȣ���ȴ��ȡ�ϲ���Һ�μӼ���AgNO3��Һ | ���ֺ�ɫ���� | N����±���� |
| D | ��Fe��NO3��2��Ʒ����ϡH2SO4�μ�KSCN��Һ | ��Һ��ΪѪ��ɫ | Fe��NO3��2���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 | B�� | 3 | C�� | 4 | D�� | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH | B�� | CH3COOH | C�� | CH3CHO | D�� | HCOOCH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
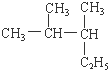 2��3-��������
2��3-��������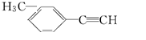
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۵㣺���ʯ��ʳ�Σ��ɱ� | B�� | ���ȶ��ԣ�HCl��H2S��PH3 | ||
| C�� | �е㣺HF��HBr��HCl | D�� | ���Ӱ뾶��Na+��Mg2+��Al3+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com