
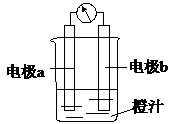 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )| A. | 原电池是将化学能转化成电能的装置 | |
| B. | 原电池由电极、电解质溶液和导线等组成 | |
| C. | 右图中a极为镁条、b极为锌片时,导线中会产生电流 | |
| D. | 右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
分析 镁、锌和橙汁构成原电池,镁易失电子作负极,锌作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该装置能构成原电池,原电池是将化学能转变为电能的装置,故A正确;
B.原电池由两个电极、电解质溶液和导线等组成,故B正确;
C.图中a极为镁条、b极为锌片时,能自发的进行氧化还原反应,所以能构成原电池,则导线中会产生电流,故C正确;
D.图中a极为锌片、b极为铜片时,锌易失电子而作负极,铜作正极,原电池放电时,电子由负极锌片通过导线流向铜片,故D错误;
故选D.
点评 本题考查了原电池原理,根据原电池的定义、正负极的判断、电子流向来分析解答即可,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
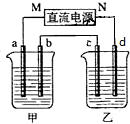 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com