


科目:高中化学 来源: 题型:
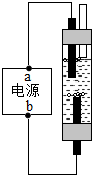 去年5月12日四川汶川发生发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液.某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
去年5月12日四川汶川发生发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液.某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.| 主要有效成分为次氯酸钠,有效氯含量8 000~10000 mg/L.可用于各类家居用品、 餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.本品须密封,置阴凉暗处保存. |
查看答案和解析>>
科目:高中化学 来源: 题型:
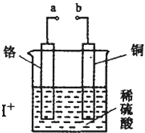 如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )
如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )| A、铜的金属性比铬强 |
| B、总反应为Cu+H2SO4═CuSO4+H2↑ |
| C、溶液中SO42-向铬极移动 |
| D、若将a接电源负极、b接电源正极,铜极反应为2H2O-4e-═O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14g乙烯和丙烯的混合物中总原子数为3 NA |
| B、常温下11.2L甲烷气体含有甲烷分子数为0.5 NA |
| C、5.6g铁与足量的稀硫酸反应失去电子数为0.3 NA |
| D、0.1mol?L-1的氢氧化钠溶液中含钠离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c(NH4)2SO4>c(NH4HSO4)>c(NH4C1) |
| B、向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、pH=6的纯水:c(H+)>c(OH-) |
| D、1.0mol/LNa2CO3溶液:c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na202晶体中阳离子和阴离子的总个数为0.4NA | ||
| B、标准状况下,1.12 LHCH0所含的原子总数是0.2NA | ||
C、agO2和O3的混合气体中所含的分子数一定为(
| ||
| D、3.2g铜与一定量的浓硝酸完全反应生成的气体分子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-221 kJ/mol |
| B、-110.5 kJ/mol |
| C、+110.5 kJ/mol |
| D、+221 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=1 |
| B、2min内A的反应速率为0.3 mol?(L?min)-1 |
| C、B的转化率为40% |
| D、若混合气体的密度不变则表明该反应达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com