
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]常用作塑料阻燃剂. 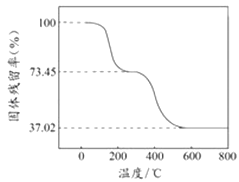
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 .
(2)[MgaAlb(OH)c(CO3)dxH2O]中的a、b、c、d的代数关系式为 .
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO2 0.560L(已换算成标准状况下).
②另取一定量样品在空气中加热,样品的固体残留率( ![]() ×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物).
×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物).
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)(写出计算过程).
【答案】
(1)生成的产物具有阻燃作用
(2)2a+3b=c+2d
(3)解:n(CO2)= ![]() =2.50×10﹣2mol,
=2.50×10﹣2mol,
m(CO2)=2.50×10﹣2mol×44g/mol=1.10g,
在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,
m(CO2)+m(H2O)=3.390g×(0.7345﹣0.3702)=1.235g,
m(H2O)=1.235g﹣1.10g=0.135g,
n(H2O)= ![]() =7.50×10﹣3 mol,
=7.50×10﹣3 mol,
再根据氢原子守恒得n(OH﹣)=2n(H2O)=1.50×10﹣2 mol,根据C原子守恒得n(CO32﹣)=n(CO2)=2.50×10﹣2mol,所以n(OH﹣):n(CO32﹣)=1.50×10﹣2 mol:2.50×10﹣2mol=3:5,
答:碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)=3:5
【解析】解:(1.)碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]受热分解最终生成MgO、Al2O3 , MgO、Al2O3的熔点较高且都不燃烧,所以有阻燃作用,
所以答案是:生成的产物具有阻燃作用;
(2.)化合物中各元素化合价的代数和为0,所以2a+3b+c+4d=(c+3d)×2,所以得2a+3b=c+2d,
所以答案是:2a+3b=c+2d;
(3.)n(CO2)= ![]() =2.50×10﹣2mol,m(CO2)=2.50×10﹣2mol×44g/mol=1.10g,
=2.50×10﹣2mol,m(CO2)=2.50×10﹣2mol×44g/mol=1.10g,
在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,
m(CO2)+m(H2O)=3.390g×(0.7345﹣0.3702)=1.235g,
m(H2O)=1.235g﹣1.10g=0.135g,
再根据氢原子守恒计算n(OH﹣),根据C原子守恒计算n(CO32﹣),从而得出二者的比值.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列是除去括号内杂质的有关操作,其中正确的是( )
A.分离苯和己烷﹣﹣分液
B.NO(NO2)﹣﹣通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)﹣﹣让气体通过盛酸性高锰酸钾溶液的洗气瓶
D.乙醇(乙酸)﹣﹣加足量NaOH溶液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
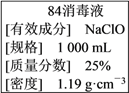
(1)消毒液”的物质的量浓度约为______ mol·L-1。
(2)某同学取100 mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
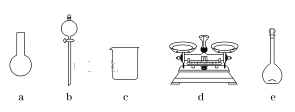
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )
A. 装置用于检验溴丙烷消去产物
装置用于检验溴丙烷消去产物
B. 装置用于石油的分馏
装置用于石油的分馏
C. 装置用于实验室制硝基苯
装置用于实验室制硝基苯
D. 装置可装置证明酸性:盐酸>碳酸>苯酚
装置可装置证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题. 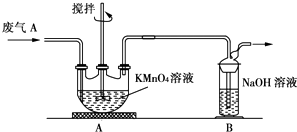
(1)同学甲设计实验检验废气A中含有CO2 , 应选择的试剂有 .
A.NaOH溶液
B.酸性KMnO4溶液
C.澄清石灰水
D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如TU装置进行实验.
①为了保证实验成功,装置A应具有的现象是 , 搅拌的目的是 .
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算.经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. 
完成下列各题:
(1)正四面体烷的分子式为 , 其二氯取代产物有种.
(2)关于乙烯基乙炔分子的说法错误的是:; a.能使酸性KMnO4溶液褪色
b.1mol乙烯基乙炔能与3mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式 .
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=﹣632kJmol﹣1 . 如图为质子膜H2S燃料电池的示意图.下列说法正确的是( ) 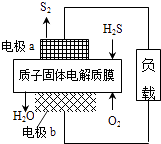
A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+2H2O+4e﹣=4 OH﹣
C.电路中每流过4mol电子,电池内部释放632kJ热能
D.每17gH2S参与反应,有1mol H+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com