
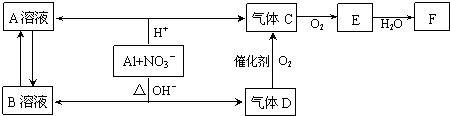
 ,
, ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
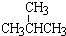 和
和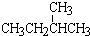 ; ②
; ② 和
和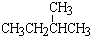 ;
;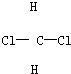 和
和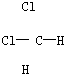
| 类别 | 同位素 | 同分异构体 | 同素异形体 | 同系物 | 同一物质 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
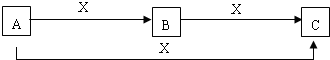
| A | B | C | X | 备注 | |
| (1) | X为单质 | ||||
| (2) | X为酸 | ||||
| (3) | X为碱 | ||||
| (4) | X为氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| 体系中各物质 | CO | H2 | CH3OH |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
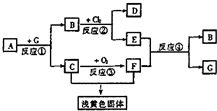 如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)
如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com