


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
A、根据②推知反应:CH3OH(l)+
| ||
| B、①反应中,反应物的总能量高于生成物总能量 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、反应②中的能量变化如图所示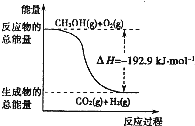 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
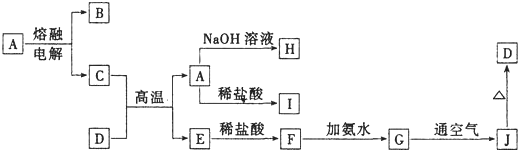
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
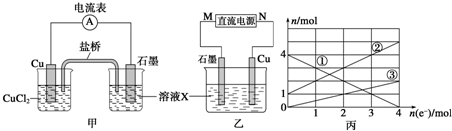
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测定两种溶液的pH时,氨水的误差更大 |
| B、若混合后溶液恰好呈中性时:c(Cl-)=c(NH4+)+c(NH3?H2O) |
| C、两溶液等体积混合时,充分反应后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、恰好反应呈中性时,所需氨水的体积大于盐酸的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com