


| ||
| ||
| ||


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| A、通入HCl(g) |
| B、加入NaHCO3(s) |
| C、加入H2O |
| D、加入NaOH(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②=③ |
| B、①>③>② |
| C、①<②<③ |
| D、①<③<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0 |
| B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 |
| C、Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0 |
| D、2H2(g)+O2(g)═2H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
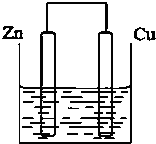 将质量相等的锌片和铜片用导线相连浸500mL硫酸铜溶液中构成如图的装置.
将质量相等的锌片和铜片用导线相连浸500mL硫酸铜溶液中构成如图的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
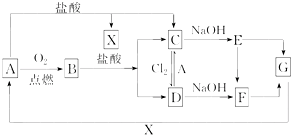 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com