
| ||
| 400℃ |
| A、16kJ | B、24kJ |
| C、32kJ | D、48kJ |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| A、Cu2+、H+、NO3- |
| B、K+、CO32-、OH- |
| C、CO32-、OH-、NO3- |
| D、K+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4+H2S=CuS↓+H2SO4 | ||||
| B、2FeCl3+Cu=2FeCl2+CuCl2 | ||||
C、Cu2(OH)2CO3
| ||||
| D、FeCl3+3NaOH=Fe(OH)3↓+3NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
查看答案和解析>>
科目:高中化学 来源: 题型:
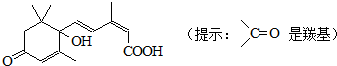
| A、含有羟基、羰基、羧基、酯基 |
| B、含有苯环、羟基、羰基、羧基 |
| C、含有碳碳双键、羟基、羰基、羧基 |
| D、含有碳碳双键、苯环、羟基、羰基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、②③⑤ |
| C、②⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Br-) |
| c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com