
| 元素 | 相关信息 |
| X | X是形成化合物类最多,它一气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成一化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气来源 |
| V | V的单质是淡黄色固体,是黑火药一主要成分 |
| W | 日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性 |
分析 X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应,则X是C元素;Y是地壳中含量最多的元素,则Y为O元素;Z和O形成一化合物Z2O2为淡黄色粉末,可作为呼吸面具里氧气来源,则Z为Na元素;V的单质是淡黄色固体,是黑火药一主要成分,则V为S元素;
W日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性,所以W为Fe;
(1)X是C元素,其原子核外有2个电子层、最外层电子数是4;W为Fe原子核外有26个电子,根据构造原理书写Y基态原子的核外电子排布式;
(2)Y为O元素,Z为Na元素,V为S元素,电子层越多离子半径越大,电子排布相同时,原子序数越大,离子半径越小;过氧化钠与水反应生成氢氧化钠和氧气;
(3)氢质量分数最大的有机物为CH4和V的单质S为原料反应生成CS2和H2S;
(4)根据已知方程式结合盖斯定律进行计算.
解答 解:X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应,则X是C元素;Y是地壳中含量最多的元素,则Y为O元素;Z和O形成一化合物Z2O2为淡黄色粉末,可作为呼吸面具里氧气来源,则Z为Na元素;V的单质是淡黄色固体,是黑火药一主要成分,则V为S元素;W日常生活中应用最广泛的金属之一,且W有几种不同价态的氧化物,其中一种有磁性,所以W为Fe;
(1)X是C元素,其原子核外有2个电子层、最外层电子数是4,所以C位于第二周期第IVA族;Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:二、IVA;1s22s22p63s23p63d64s2;
(2)Y为O元素,Z为Na元素,V为S元素,电子层越多离子半径越大,电子排布相同时,原子序数越大,离子半径越小,所以S2->O2->Na+,过氧化钠与水反应生成氢氧化钠和氧气,其离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
故答案为:S2->O2->Na+;2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)氢质量分数最大的有机物为CH4和V的单质S为原料反应生成CS2和H2S,则其反应的方程式为:CH4+4S $\frac{\underline{\;一定条件下\;}}{\;}$CS2+2H2S;
故答案为:CH4+4S $\frac{\underline{\;一定条件下\;}}{\;}$CS2+2H2S;
(4)已知:W2Y3(s)+3XY(g)=2W(s)+3XY2(g)△H=-26.7kJ•mol-1 ①,
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g)△H=-50.75kJ•mol-1 ②,
W3Y4(s)+XY(g)=3WY(s)十XY2(g)△H=-36.5kJ•mol-1 ③,
根据盖斯定律,把方程式①×$\frac{1}{2}$-②×$\frac{1}{6}$-$\frac{1}{3}$×③得反应WY(s)+XY(g)=W(s)+XY2(g)△H=-26.7×$\frac{1}{2}$-(-50.75×$\frac{1}{6}$)-($\frac{1}{3}$×-36.5)=+7.3 kJ•mol-1.
故答案为:+7.3 kJ•mol-1.
点评 本题考查位置结构性质的相互应用,涉及元素的推断、离子方程式的书写、盖斯定律的应用等知识点,明确基本概念、基本理论即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
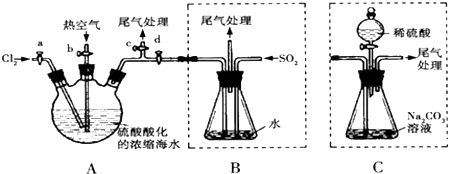
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL0.1 mol•L-1氨水与10 mL0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
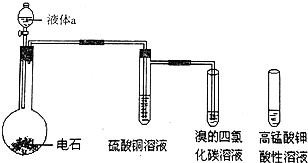 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +1 | C. | 0 | D. | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| C. | 使用生物酶降解生活废水中的有机物,可防止水体的富营养化 | |
| D. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 | |
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H20+O2+4e-═4OH- | |
| C. | 在轮船底镶嵌锌块以保护船体,利用的是牺牲阳极保护法 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com