
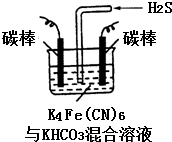
 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.分析 (1)氢化羰基铁为二元弱酸,结合原子守恒分析书写化学方程式;氢化羰基铁为二元弱酸,在溶液中分两步电离;
(2)根据Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价来解答;
(3)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
(4)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断;
(5)pH为3时,c(OH-)=10-11mol/L,结合Ksp(Fe(OH)2)=c(Fe2+)×c2(OH-)=8.0×10-38,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe2+):c(Fe3+).
解答 解:(1)Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼,易于吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠,依据题干信息推知,反应的化学方程式为:Fe(CO)5+H2=H2Fe(CO)4+CO;
氢化羰基铁为二元弱酸,在溶液中分两步电离,其电离方程式为:H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
故答案为:Fe(CO)5+H2=H2Fe(CO)4+CO;H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
(2)因Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价,所以由Fe2O3形成一个Fe3O4得到1个电子,则每生成1mol Fe3O4,转移电子的物质的量为1mol;
故答案为:1mol;
(3)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
(4)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,则阳极的反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大;
(5)pH为3时,c(OH-)=10-11mol/L,则1.0mol FeSO4溶液中c(Fe2+)×c2(OH-)=10-22<8.0×10-16,没有沉淀生成,则c(Fe2+)=1.0mol/L,
由Ksp(Fe(OH)3)=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-11})^{3}}$mol/L=4×10-5mol/L,则c(Fe2+):c(Fe3+)=2.5×104,
故答案为:2.5×104.
点评 本题以铁的化合物的性质为知识背景,考查了弱电解质的电离、盐的水解原理的应用、电解原理的应用、溶度积常数的计算等,题目综合性较强,难度较大,侧重于考查学生对基础知识的综合应用能力和计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
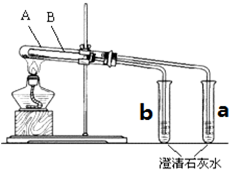 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
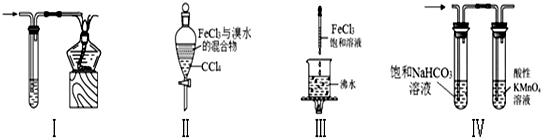
| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com