
����Ŀ����1������ͼ��ʾ�������ݻ�Ϊ���ҵ��������¶���ͬ���ֱַ�����ͼ��ʾ�����������壬ͬʱ���������������ʹ�����������ַ�Ӧ�ﵽƽ�⣬������������Ӧ�ٴδﵽƽ�⣬����˵����ȷ����_____

A����һ��ƽ��ʱ��SO2�����ʵ������Ҹ���
B��ͨ������δ��Ӧǰ������ѹǿ������һ����
C����һ��ƽ��ʱ��������ѹǿһ��С������
D���ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2�����ʵ�����2����Ҫ��
��2��NH3�ϳɳ����Ļ������ء���ѧʽΪCO(NH2)2����Ϊ���������е�һ��Ϊ��2NH3(g)+CO2(g)![]() NH2COONH4(s) ��H= -159.5kJ/mol�����������Ӧ����2L�����ܱ������г���2molNH3��1molCO2��ƽ��ʱ�ų�127.6kJ������������Ӧ�¶Ȳ��䣬�ڸ������г���2.8molNH3��1.4molCO2������ƽ��ʱ��c��NH3��Ϊ___________��
NH2COONH4(s) ��H= -159.5kJ/mol�����������Ӧ����2L�����ܱ������г���2molNH3��1molCO2��ƽ��ʱ�ų�127.6kJ������������Ӧ�¶Ȳ��䣬�ڸ������г���2.8molNH3��1.4molCO2������ƽ��ʱ��c��NH3��Ϊ___________��
��3���������£���0.5mol/L������Һ�м�������ˮ����ˮ�������c(H+)��c(OH��)_________�������������������С��������������
����֪Ksp��Ag2CrO4��=1.0��10��12����0.2mol/L��AgNO3��Һ�м���������0.00008mol/LK2CrO4��Һ������Һ�е�c(CrO42��)=___________��
�������£�0.1mol/LNaHCO3��Һ��pHֵ______0.1mol/LNa2SO3��Һ��pHֵ������>������<������=������֪��
H2CO3 | K1=4.3��10��7 | K2=5.6��10��11 |
H2SO3 | K1=1.54��10��2 | K2=1.02��10��7 |
��4����һ�ֿɳ����Na��Al/FeS����ع���ʱNa+�����ʵ������ֲ��䣬�������ú�Na+�ĵ��������Ϊ����ʣ���֪�õ��������ӦʽΪ2Na++FeS+2e��=Na2S+Fe����õ���ڳ��ʱ������������Ӧ��������____________���ŵ�ʱ������ӦʽΪ__________________��
���𰸡� BC 0.2mol/L ��С 1.0��10-10mol/L �� Na2S��Fe Na - e- = Na+
��������������������⿼��ƽ��ʱ��������С�ıȽϣ���ѧƽ��ļ��㣬Ӱ������ˮ������غ�����ˮ��Ĺ��ɣ��ܶȻ��ļ��㣬�ɳ���صĹ���ԭ����
��1�������з����ķ�ӦΪ2SO2��g��+O2��g��![]() 2SO3��g����A�������ҵ��ݻ���������������Һ���������ͬ�����ﵽ��ƽ��״̬��ͬ�����е�SO2���ʵ�������������ڴ�ƽ��ʱ�������СΪ1/2������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ������٣���һ��ƽ��ʱ��SO2���ʵ������Ҹ��࣬A�����B��ͨ������δ��Ӧǰ���������������ʵ���Ϊ2mol+1mol+1mol=4mol���������������ʵ���Ϊ2mol�������ݻ�Ϊ���ҵ��������¶���ͬ��������ѹǿ������һ����B����ȷ��C�����Ҵ�����Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿС��������ʼѹǿ�����Ҵ��淴Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿ����������ʼʱѹǿ��������������ʼѹǿ��ȣ����һ��ƽ��ʱ������ѹǿһ��С�����ң�C����ȷ��D�������ݻ�Ϊ2�������ݻ�����������ʼ����4molSO2��2molO2����ͬ�����´ﵽƽ��ʱSO2���ʵ���Ϊ����SO2���ʵ�����2���������൱���ݻ�Ϊ1.5�������ݻ�����������ʼ����2molSO2��1molO2��2molSO3��g����1molAr����Ч���ݻ�Ϊ1.5�������ݻ�����������ʼ����4molSO2��2molO2��1molAr�������2�������ݻ���������С���������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ�����С�����ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2���ʵ�����2��Ҫ�٣�D�����ѡBC��
2SO3��g����A�������ҵ��ݻ���������������Һ���������ͬ�����ﵽ��ƽ��״̬��ͬ�����е�SO2���ʵ�������������ڴ�ƽ��ʱ�������СΪ1/2������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ������٣���һ��ƽ��ʱ��SO2���ʵ������Ҹ��࣬A�����B��ͨ������δ��Ӧǰ���������������ʵ���Ϊ2mol+1mol+1mol=4mol���������������ʵ���Ϊ2mol�������ݻ�Ϊ���ҵ��������¶���ͬ��������ѹǿ������һ����B����ȷ��C�����Ҵ�����Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿС��������ʼѹǿ�����Ҵ��淴Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿ����������ʼʱѹǿ��������������ʼѹǿ��ȣ����һ��ƽ��ʱ������ѹǿһ��С�����ң�C����ȷ��D�������ݻ�Ϊ2�������ݻ�����������ʼ����4molSO2��2molO2����ͬ�����´ﵽƽ��ʱSO2���ʵ���Ϊ����SO2���ʵ�����2���������൱���ݻ�Ϊ1.5�������ݻ�����������ʼ����2molSO2��1molO2��2molSO3��g����1molAr����Ч���ݻ�Ϊ1.5�������ݻ�����������ʼ����4molSO2��2molO2��1molAr�������2�������ݻ���������С���������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ�����С�����ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2���ʵ�����2��Ҫ�٣�D�����ѡBC��
��2�������Ȼ�ѧ����ʽ��ÿ����2molNH3��1molCO2����Ӧ�ų�159.5kJ�������ų�127.6kJ����ʱn��NH3��ת��=![]() =1.6mol��n��CO2��ת��=
=1.6mol��n��CO2��ת��=![]() =0.8mol��ƽ��ʱn��NH3��=2mol-1.6mol=0.4mol��n��CO2��=1mol-0.8mol=0.2mol��ƽ��ʱc��NH3��=0.2mol/L��c��CO2��=0.1mol/L�����¶��»�ѧƽ�ⳣ��K=
=0.8mol��ƽ��ʱn��NH3��=2mol-1.6mol=0.4mol��n��CO2��=1mol-0.8mol=0.2mol��ƽ��ʱc��NH3��=0.2mol/L��c��CO2��=0.1mol/L�����¶��»�ѧƽ�ⳣ��K=![]() =
=![]() =250�����������г���2.8molNH3��1.4molCO2�������ʼ��ƽ��ת��CO2���ʵ���Ũ��Ϊx��������ʽ
=250�����������г���2.8molNH3��1.4molCO2�������ʼ��ƽ��ת��CO2���ʵ���Ũ��Ϊx��������ʽ
2NH3��g��+CO2��g��![]() NH2COONH4��s��
NH2COONH4��s��
c����ʼ����mol/L�� 1.4 0.7
c��ת������mol/L�� 2x x
c��ƽ�⣩��mol/L�� 1.4-2x 0.7-x
![]() =250�����x=0.6mol/L������ƽ��ʱ��c��NH3��=1.4mol/L-2
=250�����x=0.6mol/L������ƽ��ʱ��c��NH3��=1.4mol/L-2![]() 0.6mol/L=0.2mol/L��
0.6mol/L=0.2mol/L��
��3����Na2CO3��Һ����ǿ�������Σ���Һ��OH-ȫ������ˮ���룬ˮ�����c��H+��=c��OH-��������Һ�м�������ˮ���ٽ�CO32-��ˮ�⣬ˮ�����OH-���ʵ�������������Һ�������c��OH-����С������ˮ�������c��H+��![]() c��OH-����С��
c��OH-������
��n��AgNO3��![]() 0.00008V=0.19984V��c��Ag+������=
0.00008V=0.19984V��c��Ag+������=![]() =0.09992mol/L����Һ��c��CrO42-��=Ksp��Ag2CrO4��
=0.09992mol/L����Һ��c��CrO42-��=Ksp��Ag2CrO4��![]() c2��Ag+��=1
c2��Ag+��=1![]() 10-12
10-12![]() 0.099922=1.0
0.099922=1.0![]() 10-10��mol/L����
10-10��mol/L����
��HCO3-��ˮ��ƽ��Ϊ��HCO3-+H2O![]() H2CO3+OH-��HCO3-��ˮ��ƽ�ⳣ��Kh=
H2CO3+OH-��HCO3-��ˮ��ƽ�ⳣ��Kh=![]() =
=![]() =
=![]() =
=![]() =2.3
=2.3![]() 10-8
10-8![]() 5.6
5.6![]() 10-11��HCO3-��ˮ��̶ȴ���HCO3-�ĵ���̶ȣ�NaHCO3��Һ�ʼ��ԣ�H2CO3��K1
10-11��HCO3-��ˮ��̶ȴ���HCO3-�ĵ���̶ȣ�NaHCO3��Һ�ʼ��ԣ�H2CO3��K1![]() H2SO3��K2��HCO3-��ˮ������
H2SO3��K2��HCO3-��ˮ������![]() SO32-��ˮ��������0.1mol/LNaHCO3��Һ��pHֵ
SO32-��ˮ��������0.1mol/LNaHCO3��Һ��pHֵ![]() 0.1mol/LNa2SO3��Һ��pHֵ��
0.1mol/LNa2SO3��Һ��pHֵ��
��4�����������ӦʽΪ2Na++FeS+2e-=Na2S+Fe����س��ʱ������ӦʽΪNa2S+Fe-2e-=FeS+2Na+�����ʱ����������Ӧ��������Na2S��Fe�����������ӦʽΪ2Na++FeS+2e-=Na2S+Fe����������Na+����ع���ʱNa+�����ʵ������ֲ��䣬���ظ�����ӦʽΪNa-e-=Na+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����500 mL 0.5 mol��L��1����������Һ�����ⶨʵ����������������Һ��Ũ��Ϊ0.45 mol��L��1�����ܵ�ԭ����(����)
A. ת��ʱ��Һû����ȴ������ B. ����ƿû�к��
C. �����������ƹ���ʱ����ŷ��� D. ����ʱ���Ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ա仯����
A. ԭ�Ӱ뾶 B. ԭ������
C. Ԫ����Ҫ���ϼ� D. Ԫ��ԭ�ӵ�ʧ���ӵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����������ֵ�ϵ���
A. ��ԭ�ӵ������� B. ԭ�Ӻ���������
C. ԭ�Ӻ��ڵ������� D. ��Ԫ�ص����ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڰ������������У�����ȷ���ǣ� ��
A.ʵ�����ư����ķ����Ǽ���NH4Cl
B.Һ���Ǵ�����
C.����Һ������˿������������
D.����������ˮ����˿���������Ȫʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ��ϡȱս����Դ���㷺Ӧ�����ڶ�����������������������ҹ�ս���մ�������ij���п�����õ���ȡ�༼��·��Ϊ����Ʒλ�ྫ��-�������������Ȼ�ԭ-��ջӷ�������-�ӷ������Ʒλ��ԭ�ྫ��-������Ԥ����-���������ᴿ-�ߴ����Ȼ���-�ߴ��������ࡣ

��1�������ڱ��н�����ǽ����ķֽ紦�������ҵ��뵼����ϣ���Si�� �ȣ��뵼���������������ǿ�ʼ�� ��������չ����������ͬ��� ������Ԫ��������_______�����ţ���
a��Ge Si Ge
b��Ge Ge Si
c��C Si Ge
��2������ƽ�����������Ȼ�ԭ��Ӧ�Ļ�ѧ����ʽ����������ע����Ӧ������
___NaH2PO2��H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO��+___H3PO4��_____________
___Na4P2O7+___H2O+___GeO��+___H3PO4��_____________
��3����Ʒλ��ԭ�ྫ�������Ԥ�������̵IJ����������ƣ���д���ù��̵Ļ�ѧ��Ӧ����ʽ��____________________________________________
��4���ߴ��������ຬ�����õ���صζ������з�������ȡ3.600g�ߴ�����������Ʒ���������������ڵ�¯�����������������Ƽ��Ȼ�ԭ��Ȼ���Ե���Ϊָʾ�����õ���ر���Һ��0.6000mol/L���ζ������ĵĵ�������Ϊ19.00mL��[20�����£����������Ʋ��ᱻ����غ͵�����]
�ٵζ��յ��������_____________________________��
�ڴ���Ʒ�ж������ຬ����_________����������λ��Ч���֣�
��5����������ԭGeO2���Ƶý����ࡣ�䷴Ӧ���£�
GeO2+ H2= GeO+ H2O ��
GeO+ H2= Ge+ H2O ��
GeO2+ 2H2= Ge+ 2H2O ��
��Ӧʽ����H=+13750 kJ/mol ����S=+15600J/(K��mol������ԭ��Ӧ���¶�һ�������_________����Χ�ڡ�[��֪GeO��700����������T(K)=t(��)+273]
��6�����������е��ܽ��ٶ�������Ũ�ȡ������ٶȡ��¶ȵ�����Ӱ�졣��ͼ�����ܽ��ٶ���һ���ֵ�������Ũ��С�ڴ�ֵʱ����Ũ�������ܽ��ٶ����ӣ���֮���ͣ�������������Ũ�ȸ�ʱ_________�Ӿ����¡�
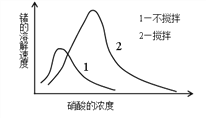
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú������Ƽ����������ϸ�������������������������ٵ�һ���ǣ� ��
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������¿��ܴ���������ǣ� ��
A. pH��2����Һ��HCO3-��Na+��ClO-��NO3-
B. 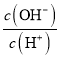 ��106����Һ��Al3+��NH4+��Cl-��S2-
��106����Һ��Al3+��NH4+��Cl-��S2-
C. ˮ�������c(H+)��10-4 mol/L����Һ��Na+��K+��SO42-��CO32-
D. ʹʯ��ʺ�ɫ����Һ��NH4+��NO3-��AlO2-��I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȩ��һ�����������.��ϳ�·��������
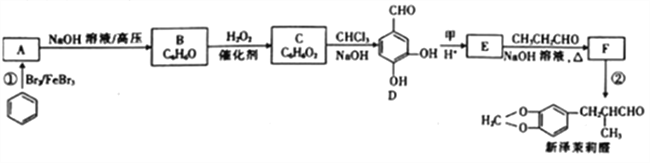
��֪:��RCHO+R'CH2CHO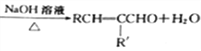
��
��1����֪����Է�������Ϊ30���Ľṹ��ʽΪ____��E�к��������ŵ�������____��
��2����Ӧ���ķ�Ӧ������____ ��
��3��д����Ӧ���Ļ�ѧ����ʽ:_________________��
��4�������廯����G��E��Ϊͬ���칹�壬1molG��������NaHCO3��Һ��Ӧ����1mol��������G�ܷ���������Ӧ����G�Ľṹ��______��������һ�ֽṹ�����ϵ�һ�ȴ������������ұ�����������C��Ӧ���ɸ߷��ӻ����д���ø߷��ӻ�����Ľṹ��ʽ:_______��
��5�������֪����������Ҵ��ͱ���ȩ![]() Ϊԭ��(���Լ���ѡ)�Ʊ�
Ϊԭ��(���Լ���ѡ)�Ʊ�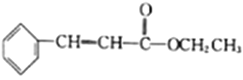 �ĺϳ�·��(�ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):__________________��
�ĺϳ�·��(�ýṹ��ʽ��ʾ�л������ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����):__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com