
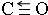 .NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.
.NH3分子中N原子的杂化方式为SP3杂化,NH3分子的空间立体构型是三角锥型.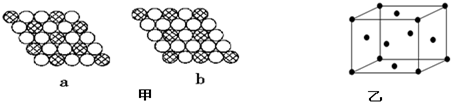
分析 Ⅰ.镓是31号元素,该原子核外有31个电子,根据能量最低原理书写核外电子排布式;
Zn原子的4s轨道为全充满状态,较稳定,第一电离能较高;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键;
NH3分子中N原子成3个N-H键、含有1对孤电子对,据此确定N原子杂化方式及空间结构;
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成氢氧化铜沉淀,继续加氨水,氢氧化铜溶解得到四氨合铜络离子,溶液呈深蓝色透明溶液,若加入极性较小的溶剂乙醇,生成的[Cu(NH3)4]SO4析出得到深蓝色的晶体;
(3)由图中直接相邻的原子数可以求出a、b中两类原子数目之比,据此确定;
(4)根据均摊法计算晶胞中Cu原子数目,结合相对分子质量及阿伏伽德罗常数表示出晶胞质量,根据晶胞棱长计算晶胞体积,再根据密度计算晶胞质量,据此列方程计算.
解答 解:Ⅰ.镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以其核外电子排布式为1s22s22p63s23p63d104s24p1;
Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,4s轨道为全充满状态,体系的能量较低,较稳定,故Zn的第一电离能大于Ga;
Ⅱ.(1)C、O原子都符合8电子稳定结构,C原子与氧原子之间存在2个普通共价键、1个配位键,C原子与氧原子之间形成三键,结构式为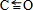 ;
;
NH3分子中N原子成3个N-H键、含有1对孤电子对,N原子杂化方式为sp3,空间结构为三角锥形,
故答案为: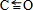 ;sp3;三角锥形;
;sp3;三角锥形;
(2)氢氧化铜与氨水发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,沉淀溶解,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体,
故答案为:氢氧化铜与氨水发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,向该溶液中加乙醇,生成的[Cu(NH3)4]SO4在极性极性的乙醇中溶解度减小而析出得到深蓝色的晶体;
(3)a图中每个斜线球周围有6个白色球,而每个白色球为3个斜线球共有,故斜线球与白色球数目之比=
1:6×$\frac{1}{3}$=1:2,
b图中每个斜线球周围有6个白色球,而每个白色球为2个斜线球共有,故斜线球与白色球数目之比=1:6×$\frac{1}{2}$=1:3,
故图b符合化学式为AX3,
故答案为:b;
(4)晶胞中含有铜原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×64}{{N}_{A}}$g,该晶胞体积为a3 cm3,则$\frac{4×64}{{N}_{A}}$g=a3 cm3×ρ g/cm3,故NA=$\frac{256}{ρ{a}^{3}}$,
故答案为:$\frac{256}{ρ{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布式、电离能、分子结构、杂化轨道、配合物、晶胞计算等,难度中等,注意利用均摊法进行晶胞有关计算,理解同周期第一电离能突跃原因.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,能与强氧化性的高锰酸钾发生氧化还原反应 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
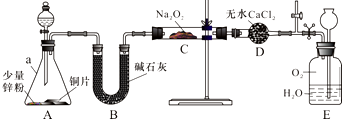 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
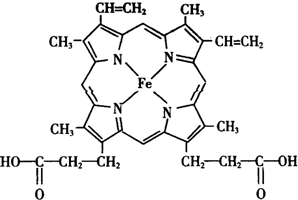 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: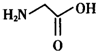 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.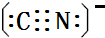 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向相同体积,相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积,可以比较两种一元酸的酸性相对较弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至恰好不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH,可以比较HClO和CH3COOH的酸性强弱 | |
| D. | 在滴有酚酞Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2的酯类 | B. | 分子式为C5H10的烯烃 | ||
| C. | 分子式为C5H12O的醇类 | D. | 分子式为C5H12的所有化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y | |
| B. | 第一电离能:X>Y | |
| C. | 气态氢化物的稳定性:HmY小于HnY | |
| D. | X与Y形成化合物时,一般显负价,Y显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com