
分析 (1)苯与液溴在Fe作催化剂条件下生成溴苯,烧瓶干燥便于HBr逸出;
(2)长导管可以导气,反应为放热反应,而苯、液溴易挥发,需要冷凝回流挥发的苯、溴;
(3)溴苯中溶解未反应的溴,溴与氯气性质类似,用氢氧化钠溶液除去溶解的溴;
(4)溴苯是无色油状液体,密度比水大,溴苯不易挥发.
解答 解:(1)苯与液溴在Fe作催化剂条件下生成溴苯,烧瓶干燥便于HBr逸出,题目说法正确,故答案为:对;
(2)反应为放热反应,而苯、液溴易挥发,烧瓶口上的导管很长,可以冷凝会挥发的苯、溴,并起导气作用,故选:D;
(3)溴苯中溶解未反应的溴,用5%的 NaOH 溶液洗涤产品的作用是除去溴苯中溶解溴,溴与氯气性质类似,与氢氧化钠溶反应方程式为2NaOH+Br2=NaBr+NaBrO+H2O,故答案为:对;对;
(4)溴苯是无色油状液体,密度比水大,溴苯不易挥发,故选:C.
点评 本题考查有机物制备,涉及实验室溴苯的制取、有机物的性质等,比较基础,注意对基础知识的理解掌握.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:填空题
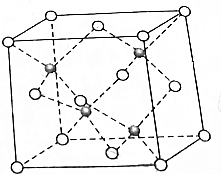 Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu,
Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu, 为F)
为F)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
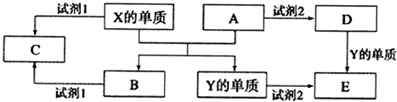
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
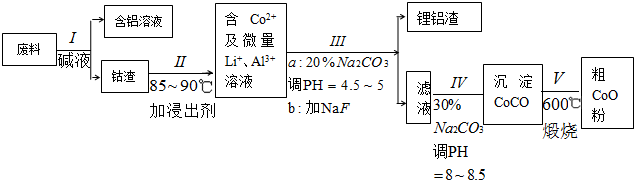
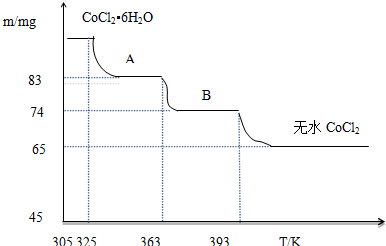
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com