
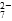 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。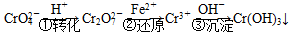
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O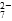 (橙色)+H2O
(橙色)+H2O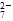 和CrO
和CrO 的浓度相同
的浓度相同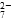 )=v(CrO
)=v(CrO )
)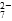 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)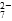 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。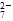 需 6 mol FeSO4·7H2O。
需 6 mol FeSO4·7H2O。

科目:高中化学 来源:不详 题型:单选题
 CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是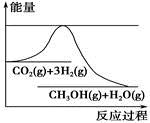
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是 | A.①② | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O ΔH1
CO(g)+H2O ΔH1 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )
2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )| A.体系的压强不再改变 |
| B.体系的温度不再改变 |
| C.断裂1 mol N≡N键的同时,也断裂6 mol N—H键 |
| D.反应消耗的N2、H2与产生的NH3的速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )| | c(NO) | c(CO) | c(CO2) | c(N2) |
| A | 1 | 1 | 0.1 | 0.1 |
| B | 0.1 | 0.1 | 0.1 | 0.1 |
| C | 0.2 | 0.1 | 0.2 | 1 |
| D | 0.3 | 0.2 | 0.2 | 0.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:| | 甲 | 乙 | 丙 | 丁 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0. 40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com