
下列表示对应化学反应的离子方程式正确的是
A.漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
B.向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
CO(g)+H2O(g)  ?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,加快了反应速率,反应的ΔH也随之改变
B.温度降低,正、逆反应速率都减小,反应放出的热量不变
C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小
D.改变压强,反应速率发生改变,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:选择题
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。

容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1 ℃ | T2 ℃ | T1 ℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:填空题
(14分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:

则H2还原NO生成氮气和水蒸气的热化学方程式是:
。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为 。上述反应的平衡常数表达式K= 。200℃时该反应的平衡常数K=64.8,则该反应的△H 0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 。
②甲与水反应可得H2,其化学方程式是:
。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式: 。

查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:选择题
下列依据相关实验得出的结论正确的是
A.向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42-
B.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合H+能力比CO32-强
C.向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热,未出现红色沉淀。证明葡萄糖中不含醛基
D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.1.0mol?L -1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42-
B.c(H+)/c(OH-)=10-11的溶液:Na+、Ba2+、NO3-、Cl-
C.滴入酚酞显红色的溶液:Ca2+、Al3+、NO3-、HCO3-
D.滴入碘化钾淀粉溶液显蓝色的溶液:Na+、Fe2+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
在H2SO4、K2SO4、Al2 (SO4)3和明矾[KAl(SO4)2·12H2O]的混合溶液中,H+的浓度为0.2mol/L,SO42-的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L B.0.25mol/L C.0.45mol/L D.0.55mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:填空题
(18分)运用物质结构的知识完成下列问题。
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号)。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

Q R
①晶体Q中不存在的作用力为 (填字母)。
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm—(含B、O、H三种元素)的球棍模型如下图3所示。则m= (填数字)。
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如下图4)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 。
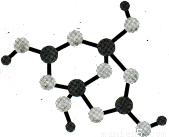
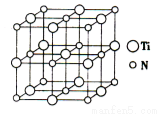
图3 图4
(6)部分化学键的键能见下表:
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低 (填“>”或“<”) SiC______ Si; SiCl4 ______ SiO2
②工业上高纯硅可通过下列反应制取:SiCl4 (g) + 2H2(g) 高温Si(s) + 4HCl(g)
计算该反应的反应热△H =___________ kJ/mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和Si B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com