
| A、NaOH |
| B、NH3?H2O |
| C、NaCl |
| D、MgCl2 |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、电解精炼铜时,阳极减少6.4g,则转移电子数一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
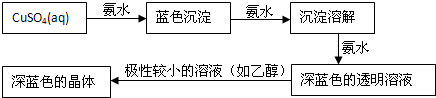
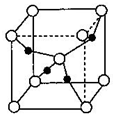
查看答案和解析>>
科目:高中化学 来源: 题型:
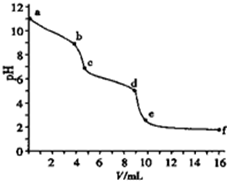
| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应后的溶液滴加酚酞,液体会变为红色 |
| B、过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 |
| C、碳酸钠俗称大苏打,碳酸氢钠俗称苏打 |
| D、氧化铝是冶炼金属铝的重要原料,也是一种比较好的耐火材料,它可以用来制造耐火坩埚,耐火管和耐高温的实验仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| LiAIH4 |
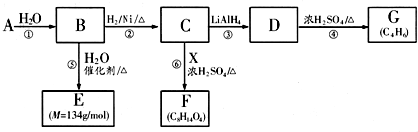
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
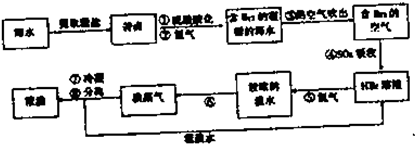
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com