
| A. | 将稀盐酸滴入Na2SiO3溶液中,有白色胶状物:SiO32-+2H+=H2SiO3(胶体) | |
| B. | 将FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3++2I-=2Fe2++I2 | |
| C. | 将小块铁片溶于过量稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 将铝片置于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
分析 A.反应生成硅酸和氯化钠;
B.发生氧化还原反应生成碘化亚铁、碘;
C.小块铁片溶于过量稀硝酸,溶液变黄,生成硝酸铁、NO;
D.反应生成偏铝酸钠和氢气.
解答 解:A.反应生成硅酸和氯化钠,离子反应为SiO32-+2H+=H2SiO3(胶体),故A正确;
B.发生氧化还原反应生成碘化亚铁、碘,离子反应为2Fe3++2I-=2Fe2++I2,遵循电子、电荷守恒,故B正确;
C.小块铁片溶于过量稀硝酸,溶液变黄,生成硝酸铁、NO,离子反应为Fe+4H++NO3-=Fe3++NO↑+2H2O,故C错误;
D.反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,遵循电荷、电子守恒,故D正确;
故选C.
点评 本题考查离子方程式的书写,为高频考点,把握物质的性质、发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中电子、电荷守恒的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 用图a所示装置干燥SO2气体 | |
| B. | 用图b所示装置蒸发KNO3溶液得硝酸钠晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氨气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
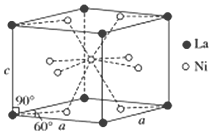 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开金属钠,钠表面的银白色逐渐退去;打磨铝箔,铝箔表面很快生成新的氧化膜 | |
| B. | 相同条件下分别与足量盐酸反应时,1molNa和1molAl分别失去1mole-和3mole- | |
| C. | 钠和铝两种元素在自然界中均以化合态形式存在 | |
| D. | 相同条件下分别与足量盐酸反应时,Na和盐酸反应更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

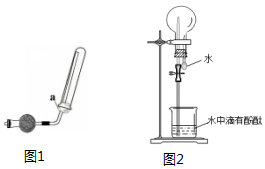
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2均可与水反应放出氧气 | |
| B. | Na2O和Na2O2中的元素的化合价均相同 | |
| C. | Na2O2与H2O反应为放热反应 | |
| D. | 在呼吸面具中,Na2O常作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
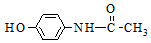
| A. | 1mol该物质最多消耗2molNaOH | B. | 该物质的分子式为C8H8NO2 | ||
| C. | 该物质能发生取代反应和加成反应 | D. | 该物质苯环上的一溴代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和浓硝酸为原料生产硝酸铜 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 由反应2SO2+O2?2SO3制SO3 | D. | 乙烯与HBr制取溴乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com