
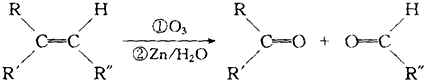
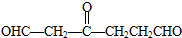
 ,则该烯烃的结构不可能是( )
,则该烯烃的结构不可能是( )| A. | 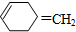 | B. | 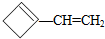 | C. | 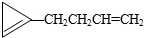 | D. | 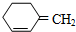 |
科目:高中化学 来源: 题型:选择题
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
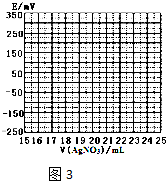
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+2H2O=4HF+O2↑ | D. | 2Na+2H2O=2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1 mol/L的NaCl溶液 | B. | 75mL 2 mol/L的NH4Cl溶液 | ||
| C. | 150mL 3 mol/L的KCl溶液 | D. | 75mL 1 mol/L的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
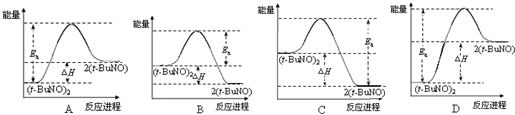
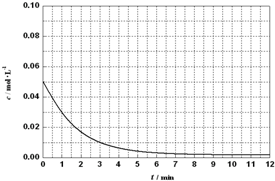
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com