
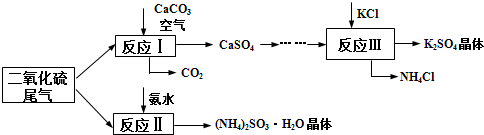
分析 I.二氧化硫、空气和碳酸钙发生反应I,根据图中反应物和生成物知,反应方程式为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,硫酸钙发生一系列反应后得到的产物和KCl反应生成氯化铵和硫酸钾,根据复分解反应特点知,反应III中还有一种反应物是硫酸铵,则反应III为2KCl+(NH4)2SO4=2NH4Cl+K2SO4(晶体),二氧化硫、氨水发生反应II,根据产物知,反应II的方程式为SO2+2NH3.H2O=(NH4)2SO3+H2O;
(1)在高温下碳酸钙、氧气和二氧化硫反应生成硫酸钙和二氧化碳;
(2)亚硫酸根离子具有还原性,能被氧化剂氧化,为防止亚硫酸根离子被氧化,应该向溶液中加入还原性物质;
(3)NH4Cl的溶解度随温度的升高而升高,要使氯化铵析出,应该降低氯化铵的溶解度;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成锰离子,离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
n(KMnO4)=1.000mol/L×0.05L=0.05mol,根据方程式知n(SO2)=$\frac{0.05mol}{2}×5$=0.125mol,
m(SO2)=0.125mol×64g/mol=8g,
尾气中SO2的含量=$\frac{二氧化硫质量}{尾气体积}×100%$;
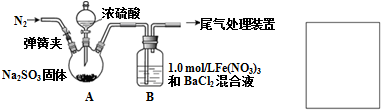
II.A中充入氮气排出空气,防止空气氧化亚硫酸钠生成硫酸钠,A中反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,二氧化硫和硝酸铁、氯化钡在B中发生反应;
(1)装置A浓硫酸和亚硫酸钠反应生成二氧化硫、水和硫酸钠;
(2)空气能氧化亚硫酸钠生成硫酸钠,为防止亚硫酸钠被氧化,应该用氮气将装置中空气排出;
(3)反应开始后,装置B中产生白色沉淀,白色沉淀的成分是BaSO4,产生白色沉淀的原因有两种观点:
观点1:SO2与Fe3+反应;
观点2:SO2与NO3-反应;
观点1中含有亚铁离子,可以用铁氰化钾或酸性高锰酸钾溶液检验;
(4)有缓冲作用的装置能防倒吸.
解答 解:I.二氧化硫、空气和碳酸钙发生反应I,根据图中反应物和生成物知,反应方程式为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,硫酸钙发生一系列反应后得到的产物和KCl反应生成氯化铵和硫酸钾,根据复分解反应特点知,反应III中还有一种反应物是硫酸铵,则反应III为2KCl+(NH4)2SO4=2NH4Cl+K2SO4(晶体),二氧化硫、氨水发生反应II,根据产物知,反应II的方程式为SO2+2NH3.H2O=(NH4)2SO3+H2O;
(1)在高温下碳酸钙、氧气和二氧化硫反应生成硫酸钙和二氧化碳,反应方程式为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2;
(2)亚硫酸根离子具有还原性,能被氧化剂氧化,为防止亚硫酸根离子被氧化,应该向溶液中加入还原性物质,对苯二酚具有还原性,能被空气氧化,所以加入对苯二酚的目的是防止生成的亚硫酸铵被氧化,
故选B;
(3)NH4Cl的溶解度随温度的升高而升高,要使氯化铵析出,应该降低氯化铵的溶解度,所以应该采用蒸发浓缩、降温结晶的方法,故答案为:蒸发浓缩、降温结晶;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成锰离子,离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
n(KMnO4)=1.000mol/L×0.05L=0.05mol,根据方程式知n(SO2)=$\frac{0.05mol}{2}×5$=0.125mol,
m(SO2)=0.125mol×64g/mol=8g,
尾气中SO2的含量=$\frac{二氧化硫质量}{尾气体积}×100%$=$\frac{8g}{aL}$=$\frac{8}{a}$g/L,
故答案为:$\frac{8}{a}$;
II.A中充入氮气排出空气,防止空气氧化亚硫酸钠生成硫酸钠,A中反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,二氧化硫和硝酸铁、氯化钡在B中发生反应;
(1)装置A浓硫酸和亚硫酸钠反应生成二氧化硫、水和硫酸钠,反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)空气能氧化亚硫酸钠生成硫酸钠,为防止亚硫酸钠被氧化,应该用氮气将装置中空气排出,为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)反应开始后,装置B中产生白色沉淀,白色沉淀的成分是BaSO4,产生白色沉淀的原因有两种观点:
观点1:SO2与Fe3+反应;
观点2:酸性条件下,SO2与NO3-反应;
观点1中含有亚铁离子,可以用铁氰化钾或酸性高锰酸钾溶液检验,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,铁氰化钾和亚铁离子生成特征蓝色沉淀,所以可以用酸性高锰酸钾溶液或铁氰化钾检验亚铁离子,
故答案为:BaSO4;酸性条件下,SO2与NO3-反应;酸性高锰酸钾溶液或铁氰化钾溶液;
(4)有缓冲作用的装置能防倒吸,其防倒吸的装置图为 ,
,
故答案为: .
.
点评 本题考查物质制备、物质性质实验方案设计,为高频考点,侧重考查学生实验操作、实验分析判断及获取信息解答问题、综合应用知识能力,明确实验原理、物质性质是解本题关键,实验操作、仪器的绘画是学生学习难点,要多练习.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 3,4-二甲基己烷 | ||
| C. | 2,2,3-三甲基戊烷 | D. | 3-甲基-3-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
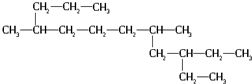 ,用系统命名法命名,该烃的名称为( )
,用系统命名法命名,该烃的名称为( )| A. | 4,8-二甲基-10-乙基12烷 | B. | 5,9-二甲基-3-乙基十二烷 | ||
| C. | 5-甲基-3-乙基-9-丙基十一烷 | D. | 3,9-二甲基-4-乙基十二烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
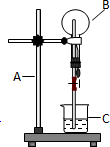 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com