
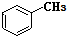
 和
和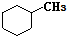 .其中互为同分异构体的是①③④(填序号).
.其中互为同分异构体的是①③④(填序号).分析 (1)具有相同分子式、不同结构的有机物为同分异构体,据此进行判断;
(2)①具有酸性的物质能与NaHCO3溶液反应,酸性乙酸>HCO3->苯酚;
②苯酚遇FeCl3溶液发生显色反应;
③上述几种物质中只有乙酸乙酯能发生水解;
④发生消去反应应含有羟基,为具有伯醇的结构;
⑤乙醛与银氨溶液发生银镜反应生成醋酸铵、Ag、氨气、水,据此写出反应的化学方程式;
(3)氯代烃在碱性条件下发生水解,加入硝酸酸化为至酸性,然后加入硝酸银溶液,如生成浅黄色沉淀,则含有溴原子,如生成白色沉淀,则含有氯原子,以此解答.
解答 解:(1)①CH3CH2CH2CH3和(CH3)2CHCH3,分子式相同,结构不同,互为同分异构体,故①正确;
②CH3CH2OH和CH3CH2CH2OH,分子式不相同,不是同分异构体,故②错误;
③CH3COOCH2CH3和CH3CH2CH2COOH,分子式相同,结构不同,互为同分异构体,故③正确;
④CH3CH=CHCH3和CH3CH2CH=CH2,分子式相同,结构不同,互为同分异构体,故④正确;
⑤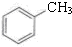 和
和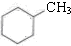 ,分子式不相同,不是同分异构体,故⑤错误;
,分子式不相同,不是同分异构体,故⑤错误;
故答案为:①③④;
(2)①具有酸性的物质能与NaHCO3溶液反应,酸性乙酸>HCO3->苯酚,则以上几种物质只有乙酸与NaHCO3溶液反应产生气泡,
故答案为:D;
②以上几种物质中只有苯酚遇FeCl3溶液发生显色反应,
故答案为:B;
③上述几种物质中只有乙酸乙酯能发生水解,
故答案为:A;
④发生消去反应应含有羟基,为具有伯醇的结构,只有乙醇符合,故答案为:E;
⑤乙醛与银氨溶液发生银镜反应生成醋酸铵、Ag、氨气、水,该反应为CH3CHO+2Ag(NH3)OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(3)①卤代烃在碱性条件下完全水解,所以加入NaOH的目的是中和卤代烃水解产生的卤化氢,使水解完全,煮沸至液体不分层,可说明氯代烃完全水解,
故答案为:促进水解的进行;使卤代烃水解完全;
②水解生成卤素离子,加入过量AgNO3,可完全生成沉淀,故答案为:使卤素离子完全沉淀;
③若加入AgNO3溶液时产生的沉淀为浅黄色,说明生成AgBr沉淀,为浅黄色,故答案为:Br.
点评 本题考查了有机物的结构与性质、蛋白质和氨基酸的化学性质,题目难度中等,试题涉及的题量较大,注意掌握常见有机物的结构与性质,对所学知识的梳理和归纳是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 在水中能电离出离子的化合物一定是离子化合物 | |
| B. | CO2分子中含极性键,且溶于水能导电,所以CO2是电解质 | |
| C. | Ca(OH)2微溶于水,所以是弱电解质 | |
| D. | CH3COOH在水中只能部分电离,所以是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的熔点比水的低、沸点比水的高 | B. | 苯的熔点比水的高、沸点比水的低 | ||
| C. | 苯的熔点、沸点都比水的高 | D. | 苯的熔点、沸点都比水的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给容器消毒 | B. | 杀死果实周围的细菌,防止霉变 | ||
| C. | 延长果实或花朵的寿命 | D. | 催熟果实或花朵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
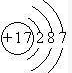 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丁烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯烃类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
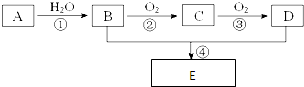
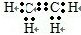 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com