
| A. | 乙酸是一种重要的有机酸,常温下是具有刺激性气味的液体 | |
| B. | 乙酸的分子式为C2H4O2,与甲酸(HCOOH)互为同系物 | |
| C. | 乙酸不能被酸性高锰酸钾稀溶液氧化 | |
| D. | 乙酸官能团的结构式为-COOH |
分析 乙酸为具有刺激性气味的液体,分子式为C2H4O2,结构简式为CH3COOH,含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
解答 解:A.乙酸为有机物,为液体,具有刺激性气味,故A正确;
B.分子式为C2H4O2,结构简式为CH3COOH,与甲酸(HCOOH)结构相似,分子式不同,互为同系物,故B正确;
C.乙酸含有羧基,不能被高锰酸钾氧化,故C正确;
D.CH3COOH含有的官能团为羧基,结构式为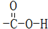 ,故D错误.
,故D错误.
故选D.
点评 本题综合考查乙酸的结构和性质,为高频考点,侧重考查学生的分析能力,有利于学生双基的夯实,难度不大,注意把握有机物的结构、性质,把握相关概念的理解.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“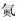 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
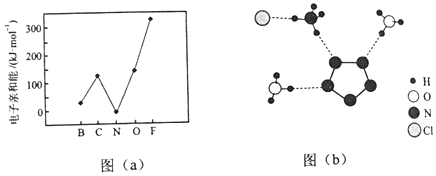
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
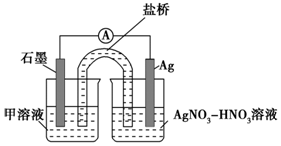
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3 mol高级脂肪酸(盐) | |
| D. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com