
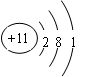
 (2分)
(2分)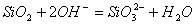 (3分);
(3分);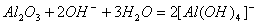 (3分)
(3分)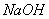 溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则说明原溶液中有
溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则说明原溶液中有 。(3分,少一关键点扣1分,直至得0分)
。(3分,少一关键点扣1分,直至得0分)

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )如下表所示:
)如下表所示: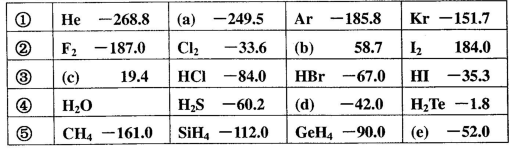
A.a、b、c的化学式分别为 、 、 、 、 |
| B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸 |
C.第④组中各化合物的稳定性顺序为: |
| D.上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com