
分析 (1)根据N=nNA结合物质的微粒构成来计算;
(2)根据c=$\frac{1000ρw%}{M}$来计算硫酸浓度,氢离子浓度是硫酸浓度的2倍,硫酸根离子浓度和硫酸浓度是相等的;
(3)根据稀释前后溶质的物质的量不变来回答.
解答 解:(1)含有3.01×1023个H2SO4分子的硫酸的物质的量是0.5mol,其中含1mol即6.02×1023个H,0.5mol即16gS,2molO,故答案为:6.02×1023;16;2;
(2)硫酸溶于水,配成质量分数为20%,密度为1.14g•cm-3的硫酸溶液,则所得硫酸溶液的物质的量浓度为$\frac{1000×1.14×20%}{98}$mol/L=2.32mol/L,溶液中H+的物质的量浓度为4.64mol•L-1,SO42-的物质的量浓度为2.32mol•L-1.故答案为:2.32;4.64;2.32.
(3)将100mL该浓度的硫酸溶液体积稀释至500mL后,所得硫酸溶液的物质的量浓度为$\frac{100mL×2.32mol/L}{500mL}$=0.464mol/L,故答案为:0.464.
点评 本题考查学生物质的量浓度的计算以及溶液的稀释规律方面的知识,属于综合知识的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol O2 | B. | 4℃时 5.4 mL 水 | ||
| C. | 10 g 氖 | D. | 6.02×1022 个 CO2 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2(b-2a)mol•L-1 | B. | 20(b-2a)mol•L-1 | C. | 20 (b-a) mol•L-1 | D. | 20(2a-b) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是( )
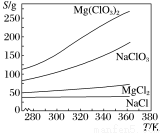
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO—+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO—+SO2+H2O= CaSO3↓+2HClO
C.氢氧 化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3—=3Fe 3++NO↑+2H2O
3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
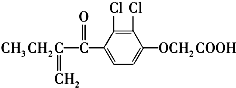 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com