

分析 硫酸工业的尾气中含有二氧化硫,反应Ⅰ是用碳酸钙、二氧化硫反应生成亚硫酸钙,再被空气中的氧气氧化成硫酸钙,反应Ⅱ为硫酸钙中加入碳酸铵和氨水,生成碳酸钙沉淀和硫酸铵,反应Ⅲ向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、趁热过滤、洗涤、干燥等操作即得K2SO4产品,反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,经除杂结晶得硫酸锰晶体,再经加热可得Mn3O4,
(1)氧气能将亚硫酸钙氧化成硫酸钙;
(2)反应Ⅱ硫酸钙中加入碳酸铵和氨水,生成碳酸钙沉淀和硫酸铵,根据电守恒和元素守恒书写离子方程式,该反应在温度太高,铵盐会分解,温度太低,反应速率太慢;
(3)根据溶解度曲线图可知,硫酸钾的溶解度较小,而氯化铵的溶解度较大,据此判断操作步骤;
(4)反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,根据元素守恒和电子得失守恒书写化学方程式;
(5)时温度与剩余固体质量变化曲线.
①MnSO4•H2O受热分解,先失去结晶水,根据剩余固体与晶体的质量比可确定A的组成;
②在冷却过程中,Mn3O4会被空气中的氧气氧化成Mn2O3或MnO2,据此答题.
解答 解:(1)氧气能将亚硫酸钙氧化成硫酸钙,所以反应Ⅰ通入足量空气的目的是保证二氧化硫在溶液中充分被氧化为硫酸钙,
故答案为:保证二氧化硫在溶液中充分被氧化为硫酸钙;
(2)反应Ⅱ硫酸钙中加入碳酸铵和氨水,生成碳酸钙沉淀和硫酸铵,反应的离子方程式为CaSO4+NH3+HCO3-=CaCO3+NH4++SO42-,该反应在温度太高,铵盐会分解,温度太低,反应速率太慢,所以反应需控制在60℃-70℃之间,其原因是加快反应速率同时防止铵盐分解,
故答案为:CaSO4+NH3+HCO3-=CaCO3+NH4++SO42-;加快反应速率同时防止铵盐分解;
(3)根据溶解度曲线图可知,硫酸钾的溶解度较小,而氯化铵的溶解度较大,所以从混合溶液中获得硫酸钾晶体的操作步骤是蒸发浓缩、趁热过滤、洗涤、干燥等,
故答案为:蒸发浓缩;趁热过滤;
(4)反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,反应化学方程式为MnO2+SO2=MnSO4,
故答案为:MnO2+SO2=MnSO4;
(5)①MnSO4•H2O受热分解,先失去结晶水,设MnSO4•H2O的物质的量为1 mol,则m(MnSO4•H2O)=1mol×169g•mol-1=169g,其中含有m(MnSO4)=1mol×151g•mol-1=151g,根据题意可知,在A处固体的质量为169g×$\frac{89.35}{100}$=151,所以A的组成为MnSO4,
故答案为:MnSO4;
②在冷却过程中,Mn3O4会被空气中的氧气氧化成Mn2O3或MnO2,会导致计算出的Mn、O的原子个数比偏小,即测得产物的总锰含量会减小,
故答案为:MnSO4部分Mn3O4又被氧化成Mn2O3或MnO2,造成总锰含量减少.
点评 本题考查物质的制备实验,为高频考点,把握物质的分享、氧化还原反应、元素守恒的计算等为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
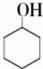 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$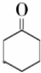
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
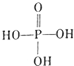
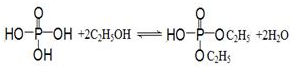 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下此反应的平衡常数K=400 | |
| B. | 其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大 | |
| C. | 平衡时,SO2的转化率为95% | |
| D. | 前2min SO2的平均反应速率0.02mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
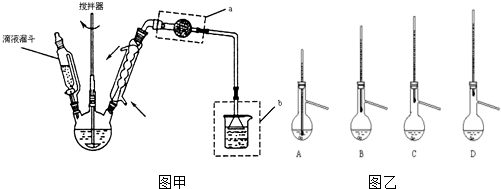
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com