
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 6.7 | 9.5 |
分析 含钴废料(含CoCO3、少量NiCO3与铁屑)加稀盐酸酸浸,得到Co2+、Ni2+、Fe2+的溶液,加氨水将Co2+、Fe2+沉淀,过滤,向沉淀中加入盐酸酸浸得到Co2+、Fe2+,向溶液中滴加适量30%H2O2,氧化亚铁离子,向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全,过滤得CoCl2溶液,减压蒸干溶液,结晶干燥得CoCl2•6H2O,据此分析解答.
解答 解:(1)硝酸酸浸时氧化Co2+产生氮氧化物,酸浸工艺中用“稀HCl”替代了传统的“盐酸与硝酸的混酸”,减少有毒气体氮氧化物的排放;防止产品中混有硝酸盐(或防止将Co2+氧化);
故答案为:减少有毒气体氮氧化物的排放;防止产品中混有硝酸盐(或防止将Co2+氧化);
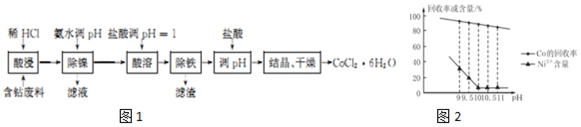
(2)由图2可知,pH=10时,Co的回收率高且Ni的含量低,流程中除镍,Co元素在滤渣中,Ni元素在滤液中,故未形成沉淀;
故答案为:10;否;
(3)除铁过程中,向将亚铁离子氧化为铁离子,调剂pH沉淀铁离子,不引入新杂质,故选择过氧化氢做氧化剂,用CoCO3调节pH,故除铁为:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液;
故答案为:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;
(4)Co2+水解,故加盐酸抑制Co2+水解;
故答案为:抑制Co2+水解;
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解;
故答案为:防止CoCl2•6H2O分解.
点评 本题考查物质分离和提纯,为高频考点,涉及氧化还原反应、物质分离和提纯方法、盐类水解、难溶物溶解平衡等知识点,侧重考查学生知识运用能力,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定是纯净物 | |
| B. | 科学家最近合成了一种新型的化合物N4 | |
| C. | 红磷转化为白磷是物理变化 | |
| D. | 纳米泡沫碳与金刚石是同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数2 NA | |
| B. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| C. | 7.8g过氧化钠用于呼吸面具中完全反应时转移电子总数为0.1 NA | |
| D. | 将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com