
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
【答案】C
【解析】
A、根据反应式可知,反应前后气体的体积不变,因此压强始终不变,则反应容器内的压强不随时间改变不能说明反应达到平衡状态,A不正确;
B、反应达到平衡时,P、Q、R、S物质的量的浓度之比可能为1﹕1﹕1﹕1,也可能不是1﹕1﹕1﹕1,这与该反应的初始分子数及转化率有关,故B错误;
C、当反应到达平衡,P的生成速率和P的消耗速率相等,而P的消耗速率和S的生成速率相等,所以P的生成速率和S的生成速率相等,故C正确;
D、根据反应式可知,反应前后气体的体积不变,因此气体的物质的量始终不变,则反应容器内的气体总物质的量不随时间变化不能说明反应达到平衡状态,故D错误,答案选C。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
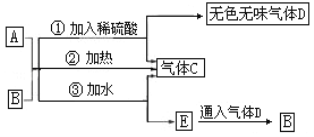
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的 CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式是_______________________。
(2)在一定温度下,向1L密闭恒容容器中充入0.5 mol NO、2 mol CO,发生上述反应,20 s时反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20s内平均反应速率υ(CO)为 ________,平衡时NO的转化率为________ ,混合气体的平均相对分子质量为 ___________。
②在该温度下反应的平衡常数K=__________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.4molCO和0.8mol N2,则此时υ正>υ逆
(3)恒温恒容下,该反应达到平衡的标志是 ________。
A、容器内压强不随时间变化 B、容器内各物质的浓度不随时间变化
C、容器内密度不随时间变化 D、容器内气体平均相对分子质量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
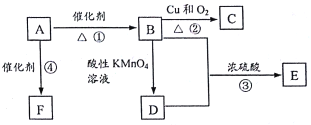
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D. H3PO2溶于水的电离方程式为H3PO2![]() H++ H2PO2-
H++ H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;G的名称______。
(2)B的结构简式_______;H的结构简式____________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)E→F的化学方程式:_____________。
(6)F→G的化学方程式:_____________。
(7)写出G的同分异构体中与CH3COOH互为同系物的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表达式正确的是( )
A. 0.5mol 稀 H2 SO 4与0.5mol 稀 Ba (OH )2溶液反应放出akJ热量,则中和热为 akJ/ mol
B. 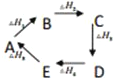 则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
C. △H与反应方程式中的化学计量数,物质的状态和可逆反应均有关
D. 同温同压下, H2( g)+ Cl 2(g)= 2HCl (g)在光照和点燃条件下的△H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com