
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
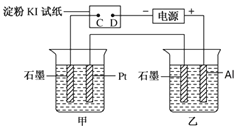
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C” 或“D”)端变蓝。
(2)装置乙中Al极的电极反应式为:_____________________。一段时间后观察到装置乙中的现象是:_________________。
(3)若电解一段时间后,装置甲中收集到气体0.056 L(标准状况下),则:装置甲中发生反应的离子反应方程式为______________________________。
(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,则电解过程中转移电子的物质的量为__________。
(5)某新型燃料电池,以甲醇为燃料,另一极通入一定量的CO2和O2的混合气体。一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为______________。正极反应式为_________________。
【答案】 C Al-3e-= Al3+ 产生白色沉淀 2Cu2+ + 2H2O![]() 2Cu + O2↑+ 4H+ 0.03mol CH3OH- 6e- + 3CO32-=4CO2+2H2O O2+4e-+2CO2=2CO32-
2Cu + O2↑+ 4H+ 0.03mol CH3OH- 6e- + 3CO32-=4CO2+2H2O O2+4e-+2CO2=2CO32-
【解析】试题分析:(1)根据图示,湿润的淀粉KI试纸构成电解池,C是阳极、D是阴极;(2)装置乙构成电解池, Al极是阳极、石墨是阴极;(3)装置甲构成电解池,Pt是阳极、石墨是阴极;
解析:(1)根据图示,湿润的淀粉KI试纸构成电解池,C是阳极,电极反应是![]() ;D是阴极,阴极反应是
;D是阴极,阴极反应是![]() ,所以湿润的淀粉KI试纸的C端变蓝;(2)装置乙构成电解池, Al极是阳极、石墨是阴极,阳极反应是
,所以湿润的淀粉KI试纸的C端变蓝;(2)装置乙构成电解池, Al极是阳极、石墨是阴极,阳极反应是![]() 、阴极反应是
、阴极反应是![]() ,一段时间后生成氢氧化铝,观察到装置乙中产生白色沉淀;(3)装置甲构成电解池,Pt是阳极、石墨是阴极,阳极反应是
,一段时间后生成氢氧化铝,观察到装置乙中产生白色沉淀;(3)装置甲构成电解池,Pt是阳极、石墨是阴极,阳极反应是![]() ,装置甲中收集到气体0.056 L(标准状况下),气体全是氧气,此时转移电子0.01mol,阴极反应只有
,装置甲中收集到气体0.056 L(标准状况下),气体全是氧气,此时转移电子0.01mol,阴极反应只有![]() ,所以装置甲中发生反应的离子反应方程式为2Cu2+ + 2H2O
,所以装置甲中发生反应的离子反应方程式为2Cu2+ + 2H2O![]() 2Cu + O2↑+ 4H+;(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,说明阴极生成0.01mol铜和0.005mol氢气,所以电解过程中转移电子的物质的量为0.03mol;(5)正极是氧气得电子发生还原反应,正极反应式是O2+4e-+2CO2=2CO32-;负极是甲醇失电子发生氧化反应,负极反应式是CH3OH- 6e- + 3CO32-=4CO2+2H2O。
2Cu + O2↑+ 4H+;(4)若电解一段时间后,装置甲中溶液需加入0.005molCu2(OH)2CO3才能恢复原来的浓度和pH,说明阴极生成0.01mol铜和0.005mol氢气,所以电解过程中转移电子的物质的量为0.03mol;(5)正极是氧气得电子发生还原反应,正极反应式是O2+4e-+2CO2=2CO32-;负极是甲醇失电子发生氧化反应,负极反应式是CH3OH- 6e- + 3CO32-=4CO2+2H2O。


科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是
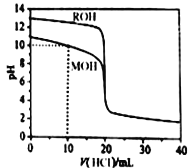
A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3溶液中加入铁粉,溶液由___色变为___色,该反应的离子方程式为______;
(2)除去FeCl3溶液中混有的FeCl2需向溶液中通入______(填物质名称),该反应的离子方程式为______;
(3)在Fe3O4 +4CO![]() 3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
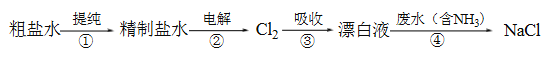
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
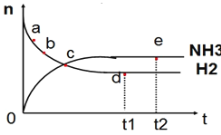
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
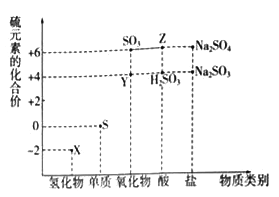
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
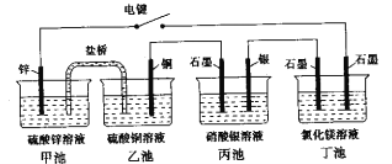
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的 PM2.5 微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_____。
(2)NO3-的立体构型是_____。
(3)PM2.5 含有大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 NOx、O3、CH2=CH—CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是_____。
A.N2O 结构式可表示为 N=N=O
B.O3 分子呈直线形
C.CH2=CH—CHO 分子中碳原子均采用 sp2 杂化
D.相同压强下,HCOOH 沸点比 CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1 mol PAN 中含σ键数目为_____(用含 NA的式子表示)。
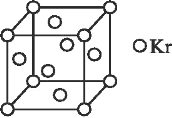
③NO 能被 FeSO4 溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为_____(填数字)。
(4)测定大气中 PM2.5 的浓度方法之一是β-射线吸收法,β-射线放射源可用 85Kr,已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子相紧邻的 Kr 原子有 m 个,晶胞中含 Kr
原子为 n 个,则m/n=___(填数字)。
(5)水分子的立体结构是_____,水分子能与很多金属离子形成配合物,其原因是在氧原子上有__________。
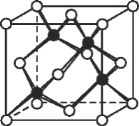
(6)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心所示原子位于立方体的 顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有_____个水分子。 冰晶胞与金刚石晶胞微粒排列方式相同的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com