
| A. | 氨水与硫酸发生中和反应速率较慢 | |
| B. | 氨水使酚酞试液变浅红色 | |
| C. | 室温下,测得0.1mol/L,氨水的pH值为11.1 | |
| D. | 氨水易挥发且导电性较差 |
分析 弱电解质的证明,是基于与强电解质对比进行的,弱电解质与强电解质最大的区别就是:弱电解质存在电离平衡,而强电解质完全电离,不存在电离平衡,因此只要证明有电离平衡存在,就证明了弱电解质;
氨水与硫酸的反应、氨水使酚酞变红色只能说明氨水具有碱性,不能判断一水合氨是弱碱;氨水具有挥发性为氨水的物理性质,无法判断氨水为弱碱;0.1 mol/L的氨水的pH值为11.1,说明溶液中铵根离子部分水解,从而证明一水合氨为弱碱.
解答 解:A.氨水能跟硫酸反应速率慢和浓度有关.不能说明氨水中一水合氨是弱碱,故A错误;
B.氨水使酚酞试液变浅红色,说明一水合氨能电离出氢氧根离子,而不能说明一水合氨的电离程度,所以不能证明一水合氨是弱电解质,故B错误;
C.如果NH3•H2O是强碱,则能完全电离,0.1 mol/L氨水中OH-浓度应为0.1mol/L,其pH应为13,但现在其pH约为11.1,即NH3•H2O不能完全电离,是弱碱,故C正确;
D.浓氨水具有挥发性,属于浓氨水的物理性质,与电解质强弱无关,不能说明一水合氨部分电离,导电性差只能说明离子浓度小,不能说明存在电离平衡,故D错误;
故选C.
点评 本题考查了强弱电解质的判断,应注意的是强弱电解质的本质区别是能否完全电离,与溶解度和导电能力无关,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的简单离子是其所在周期中元素的简单离子半径最小的 | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Y与W形成的化合物一定能使酸性高锰酸钾溶液腿色 | |
| D. | 最高价氧化物对应水化物的酸性X比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、醋、糖都有防腐功效 | |
| B. | 煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性 | |
| C. | 鸡蛋煮熟后,蛋白质水解成了氨基酸 | |
| D. | 月饼包装中的还原铁粉小包和旺旺仙贝包装中的生石灰小包的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物LiAl具有强还原性,作负极材料 | |
| B. | 为了延长电池的使用寿命,可以隔一段时间添加含电解质的水溶液 | |
| C. | 放电时,该电池的总反应式为2Li+FeS═Li2S+Fe | |
| D. | 放电时,当电路中0.1mol电子的电量时,有0.1molLi+向LiAl移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
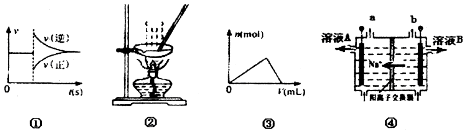
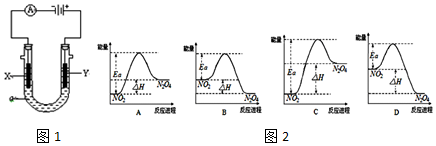
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 曲线图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧饭化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com