
| A. | 羟基的电子式: | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: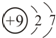 |
分析 A.羟基为中性原子团,含有1个氢氧键,氧原子最外层电子数为7;
B. 为甲烷的比例模型,球棍模型用短棍和大小不同小球表示;
为甲烷的比例模型,球棍模型用短棍和大小不同小球表示;
C.乙烯的分子式为C2H4,最简式为分子中各原子数的最简比,据此判断其最简式;
D.氟离子的核外电子总数为10,最外层满足8电子稳定结构.
解答 解:A.氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,正确的电子式为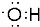 ,故A错误;
,故A错误;
B. 为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: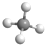 ,故B错误;
,故B错误;
C.乙烯的分子式为C2H4,则其最简式为:CH2,故C正确;
D.氟离子核内有9个质子,核外有10个电子,氟离子的结构示意图为: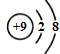 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度不大,涉及电子式、球棍模型与比例模型、离子结构示意图、最简式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 正反应速度 vA=2mol/(L•min)逆反应速度vB=2 mol/(L•min) | |
| B. | 正反应速度 vA=2mol/(L•min)逆反应速度vC=2 mol/(L•min) | |
| C. | 正反应速度 vA=1mol/(L•min)逆反应速度vB=1.5 mol/(L•min) | |
| D. | 正反应速度 vA=1mol/(L•min)逆反应速度vC=1.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )
X、Y、Z、W四种物质的转化关系如图所示(部分反应物与产物已略),下列组合中不符合该关系的是( )| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
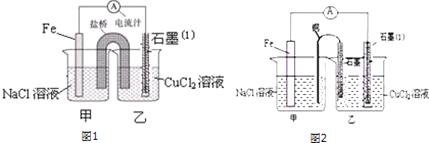
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
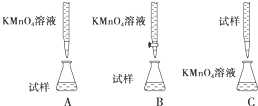

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知化学反应N2+3H2═2NH3的能量变化如图所示,
已知化学反应N2+3H2═2NH3的能量变化如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴随有能量变化的物质变化都是化学变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H1,反应2SO2(s)+O2(g)?2SO3(g)△H2,则△H1>△H2 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com