
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2 BaSO4↓+Al(OH)3↓ |
分析 A.乙酸在离子反应中保留化学式;
B.碳酸氢钙完全反应,生成碳酸钙、碳酸钠、水;
C.反应生成氯化钠、次氯酸钠和水;
D.使SO42-恰好完全沉淀,以1:2反应生成硫酸钡、偏铝酸钾、水.
解答 解:A.乙酸与碳酸钠溶液反应的离子反应为2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O,故A错误;
B.向碳酸氢钙溶液中加入过量氢氧化钠溶液的离子反应为Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O,故B错误;
C.冷的氢氧化钠溶液中通入氯气的离子反应为Cl2+2OH-═ClO-+Cl-+H2O,故C正确;
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀的离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
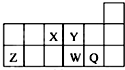
| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C原子的轨道表示式: | |
| B. | N原子轨道表示式: | |
| C. | Cr基态原子核外电子排布式:[Ar]3d54s1 | |
| D. | Ca原子的电子排布式:[Ar]3d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
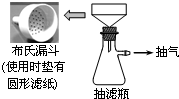 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com