
【题目】常温下,用![]() 溶液,分别滴定
溶液,分别滴定![]() 浓度均为
浓度均为![]() 溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是
溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是![]()

A.点![]() 和点
和点![]() 所示溶液中:
所示溶液中:![]()
B.醋酸的滴定终点是![]()
C.滴定![]() 过程中不可能出现:
过程中不可能出现:![]()
D.滴定HCN过程中可以用酚酞试液指示终点
【答案】A
【解析】
根据图知,相同浓度的HCN和![]() 溶液中,pH:
溶液中,pH:![]() ,说明
,说明![]() 酸性大于HCN,分别加入20mLNaOH溶液时,其溶质分别是NaCN和HCN、
酸性大于HCN,分别加入20mLNaOH溶液时,其溶质分别是NaCN和HCN、![]() 和
和![]() 且物质的量浓度相等;
且物质的量浓度相等;
A. 任何电解质溶液中都存在物料守恒,点![]() 和点
和点![]() 所示溶液中,根据物料守恒得
所示溶液中,根据物料守恒得![]() ,
,![]() ,则
,则![]() ,所以得
,所以得![]() ,故A正确;
,故A正确;
B. 理论上,滴定终点时,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显碱性,而![]() 处,溶液显中性,说明醋酸稍微过量,故B错误;
处,溶液显中性,说明醋酸稍微过量,故B错误;
C. 当刚刚开始滴定时,加入的氢氧化钠很少,溶液显酸性,溶液中醋酸分子的浓度最大,此时溶液中离子浓度关系为:![]() ,故C错误;
,故C错误;
D. 当加入20mLNaOH溶液时,其溶质是等物质的量浓度的NaCN和HCN,此时溶液的pH在![]() 之间,即只有一半HCN参加反应时,已达到酚酞的变色范围,所以不能用酚酞试液指示终点,故D错误;
之间,即只有一半HCN参加反应时,已达到酚酞的变色范围,所以不能用酚酞试液指示终点,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
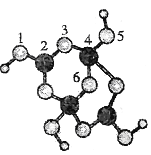
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。
⑥做过银镜反应实验后的试管,用氨水洗涤。
A. ①②④⑤⑥ B. ①②③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定实验是中学化学的重要实验之一。下列有关说法错误的是![]() 滴定过程的其他操作均正确
滴定过程的其他操作均正确![]()
A.滴定管洗净后,应用待装液润洗![]() 次
次
B.用![]() 酸式滴定管量取
酸式滴定管量取![]()
![]() 溶液
溶液
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.滴定前滴定管内无气泡,终点读数时有气泡,所滴加液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。
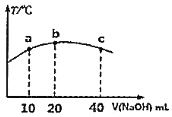
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
![]() 从b点到c点,混合溶液中一直存在:
从b点到c点,混合溶液中一直存在:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com