
对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol﹣1最准确的理解是( )
A.碳和水反应吸收131.3 kJ热量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量
C.1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
考点:
反应热和焓变..
专题:
化学反应中的能量变化.
分析:
A、反应的热量变化和反应物、生成物物质的量、聚集状态有关;
B、反应吸热,不是放热反应;
C、据热化学方程式的含义解答;
D、热化学方程式的化学计量数只表示物质的量.
解答:
解:A、碳与水反应吸收131.3 kJ的热量,未指明物质的量和聚集状态,故A错误;
B、1mol碳和1mol水反应吸收131.3 kJ的热量,故B错误;
C、1mol固态焦炭与1mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量,故C正确;
D、热化学方程式的化学计量数只表示物质的量,不表示分子个数,故D错误;
故选C.
点评:
本题考查了热化学方程式的书写方法和表达意义,注意物质聚集状态、物质的量和焓变对应,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3-
B.有大量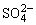 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量 存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示 对应的装置合理、操作规范的是
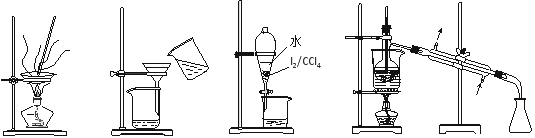
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出
B.向FeSO4溶液中通入过量CO2,有浑浊现象产生
C.SO2具有漂白性,常用于自来水消毒
D.Fe和Br2混合加热生成FeBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)斜长石(KAlSi3O8)和NaCl熔浸可制得KCl,原理是:
NaCl(l) + KAlSi3O8(s) KCl(l)+ NaAlSi3O8(s)。
KCl(l)+ NaAlSi3O8(s)。
①. 斜长石含有的化学键类型有_________________。
②. 上述反应涉及的元素原子中,半径最大的是 ,它和氢元素形成的化合物的电子式为 __________。
(2)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓由
大到小的顺序为 。
(3)亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
①.往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式:
。
② .碲酸(H6TeO6)氧化性比浓硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: HI+ H6TeO6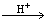 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
若反应中生成的TeO2与Te的物质的量之比为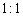 ,试配平上述化学方程式。
,试配平上述化学方程式。
已知Cu(OH)2 能溶解在足量的氨水中,则其离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ/mol
根据上述反应,下列说法正确的是( )
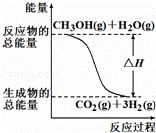
|
| A. | 反应①中的能量变化如图所示 |
|
| B. | CH3OH转变成H2的过程一定要吸收能量 |
|
| C. | 1mol CH3OH充分燃烧放出的热量为192.9kJ |
|
| D. | 可推知2H2(g)+O2(g)═2H2O(g)△H=﹣483.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol﹣1
②N2(g)+3H2(g)⇌2NH3(g)△H2=﹣92.4kJ•mol﹣1
③2H2(g)+O2(g)═2H2O(g)△H3=﹣483.6kJ•mol﹣1
下列说法正确的是( )
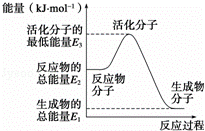
|
| A. | 反应②中的能量变化如图所示,则△H2=E1﹣E3 |
|
| B. | H2的燃烧热为241.8 kJ•mol﹣1 |
|
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
|
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的沸点:Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com