
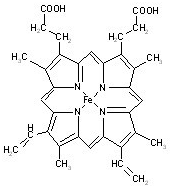
 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.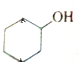 )中有3个手性碳原子.
)中有3个手性碳原子. 分析 (1)核外有多少电子,就有多少种运动状态不同的电子,基态铁原子核外有26个电子,根据核外电子排布规律书写基态原子的电子排布式,根据基态铁原子核外电子排布书写价层电子排布式;
(2)血红素的中心离子为Fe2+,配位数指与铁离子共价的原子,根据杂化理论分析碳原子的杂化方式;
(3)同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族,第ⅤA族的大于第ⅥA族;原子数总数相同、电子总数相同的微粒,互称为等电子体;
(4)分子之间存在氢键沸点升高,同类型,相对分子质量越大,沸点越高;
(5)A.根据CH4和NH4+的微粒空间结构判断键角;
B.根据杂化理论分析H2O、O3分子空间结构;
C.单键为σ键和双键为σ键和π键,三键含1个σ键和2个π键;
D.有机分子中碳原子连四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子).
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,核外有26个电子,有26种完全不同的电子,基态Fe原子核外处在能量最高的能级为3d,3d上存在4个未成对电子,所以基态铁原子价层电子为3d64s2,
故答案为:26;3d64s2;
(2)血红素的中心离子为Fe2+,与铁离子共价的原子有4个,所以配位数为4,血红素分子结构中碳原子有甲基、亚甲基、碳碳双键、碳氧双键、碳氮单键,所以其杂化为sp2和sp3,
故答案为:4;sp2和sp3;
(3)血红素中含有C、H、O、N、Fe五种元素,同一周期元素的第一电离能随着原子序数的增大而增大,As和Fe属于同一周期,第一电离能As>Fe,同一主族元素的第一电离能随着原子序数的增大而减小,N和As属于同一主族,所以第一电离能N>As、,C、N、O属于同一周期,但第五主族元素的第一电离能大于第六主族元素的,所以C、N、O三种元素的第一电离能由小到大的顺序是C、O、N;氢元素的第一电离能最小,所以血红素的组成元素中,第一电离能最大的是N,NH3为4原子10电子微粒,由血红素的组成元素所组成的离子与氨气等电子体的为:H3O+,
故答案为:N;H3O+;
(4)C、O、N三种非金属元素所对应的最简单的氢化物分别为:CH4、H2O、NH3,都形成分子晶体,H2O、NH3分子之间存在氢键,CH4分子间不能形成氢键,H2O相对分子质量最大,故沸点:H2O>NH3>CH4,
故答案为:H2O>NH3>CH4;
(5)A.CH4和NH4+都为正四面体结构,键角都为109.18′相同,故A正确;
B.H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形(折线形)结构;O3中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形(折线形),都是折线形,故B正确;
C.CO2结构式为O=C=O,每个CO2含有两个σ键和两个π键,HCN结构式为H-C≡N,每个HCN分子含有两个σ键和两个π键,故C正确;
D.龙脑分子( 中只有与羟基相连的碳原子为手性碳原子,故D错误;
中只有与羟基相连的碳原子为手性碳原子,故D错误;
故答案为:ABC.
点评 本题主要考查了基态原子的核外电子排布、键角、氢化物的沸点、配位键等知识,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握血红素分子结构获取解题信息.


科目:高中化学 来源: 题型:解答题
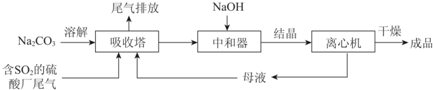
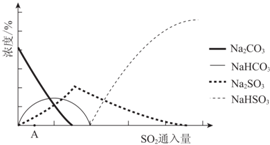
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
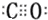 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
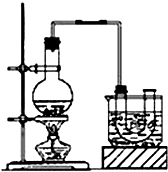 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
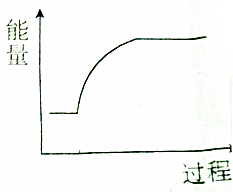
| A. | 钠与水反应 | B. | 钠的熔化过程 | ||
| C. | 氢氧化钠溶液与稀盐酸反应 | D. | Na2O2+H2O→NaOH+O2(未配平) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 6g | C. | 12.4g | D. | 8.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
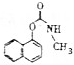 )在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(
)在农业上可应用于防治稻飞虱、叶蝉、蓟马、豆蚜、大豆食心虫、棉铃虫及果树害虫、林业害虫等.下面是用萘酚(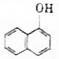 )合成西维因的反应:
)合成西维因的反应: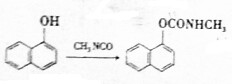
| A. | 该反应为加成反应 | |
| B. | 可用FeCl3溶液检验萘酚是否完全反应 | |
| C. | 萘酚与苯酚互为同系物 | |
| D. | 1mol西维因最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
混合气体由CH4和N2组成,测得混合气体在标准状况下的密度为0.893g/L,则混合气体中N2和CH4的体积之 比为
比为
A.1:2 B.1:4 C.2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴定操作中,滴定管和锥形瓶都需要用待装溶液润洗 | |
| B. | 酸性溶液中,Fe2+、SO2-4、K+、NO-3能大量共存 | |
| C. | SO2具有漂白性,将其通人石蕊溶液中,溶液先变红后褪色 | |
| D. | 常用丁达尔效应区分溶液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com