
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
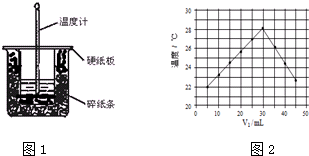
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)根据温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度一共3次;根据不同温度计的误差不同;
(3)先判断三次反应温度差的有效性,然后求出平均值,再根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(4)A.实验时的温度应为酸碱未混合之前的温度;
B.此实验表明化学能可以转化为热能;
C.恰好反应时参加反应的氢氧化钠溶液的体积是30mL,由V1+V2=50mL可知,消耗盐酸的体积为20mL,以此计算盐酸的浓度;
D.根据一个反应无法得出此结论;
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
故答案为:环形玻璃搅拌器;
(2)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度一共3次;不同温度计的误差不同,
故答案为:3;不同意,因为不同温度计误差不同;
(3)3次反应前后温度差分别为:6.7℃、6.9℃、8.5℃,第3组误差较大,舍去,平均值为6.8℃,50mL 1.0mol/L的盐酸与50mL 1.1mol/L的NaOH溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×100g×6.8℃=2.8424kJ,即生成0.5mol的水放出热量2.8424kJ,所以生成1mol的水放出热量为$\frac{2.8424kJ}{0.05}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(4)A.温度为22℃时加入了5mL氢氧化钠溶液,中和反应为放热反应,则做该实验时环境温度低于22℃,故A错误;
B.由图示可以看出该反应过程放出热量,表明化学能可以转化成热能,故B正确;
C.恰好反应时参加反应的氢氧化钠溶液的体积是30mL,由V1+V2=50mL可知,消耗的盐酸的体积为20mL,恰好反应时消耗HCl的物质的量是n,由HCl+NaOH=NaCl+H2O可知,n=1.0mol•L-1×0.03L=0.03mol,所以浓度c=$\frac{0.03mol}{0.02L}$=1.5mol/L,故C错误;
D.只是该反应放热,其他有水生成的反应不一定放热反应,故D错误;
故选C.
点评 本题考查了中和反应测定与计算、反应中能量转化关系,准确把握图象及中和反应的实质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定不含共价键 | B. | 化学键的形成与原子结构无关 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液 Al+2OH-→AlO2-+H2↑ | |
| B. | 铁跟稀硫酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com