
分析 (3)②根据碘能使淀粉变蓝色选择试剂;
(4)②橙汁呈酸性,用酸式滴定管取用;
③滴定时左手控制活塞;根据反应的原理,当出现溶液变蓝色且半分钟内不褪色时,维生素C已全部参加了反应;
(5)根据反应C6H8O6+I2→C6H6O6+2H++2I-及题中碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg,可以计算出橙汁中维生素C的含量;
(6)新鲜橙汁中维生素C的含量在500mg/L左右分析判断.
解答 解:(3)②利用I2氧化维生素C,根据碘使淀粉显蓝色的性质,应选择淀粉作指示剂,
故答案为:淀粉溶液;
(4)②橙汁呈酸性,用酸式滴定管取用,向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂;
故答案为:酸式滴定管;
③在滴定时左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点;根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:活塞;锥形瓶中溶液颜色的变化;最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色;
(5)15ml标准碘溶液含有碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg
设20.0mL待测橙汁中维生素C的质量为X
C6H8O6+I2→C6H6O6+2H++2I-
176 254
X 28.575mg
解得:X=19.8mg
则1L中含维生素C的质量为:19.8mg×1000ml/20ml=990mg,
所以,则此橙汁中维生素C的含量是990mg/L,
故答案为:990;
(6)新鲜橙汁中维生素C的含量在500mg/L左右分析判断,从分析数据看此橙汁中维生素C的含量是990mg/L,此软包装橙汁不是纯天然橙汁,可能采取的做法是将维生素C作为添加剂;
故答案为:不是.
点评 本题考查了橙汁中维生素C的含量,属于综合实验题,完成本题时要注意题中数据的处理,合理进行误差的分析等,本题难度中等.


科目:高中化学 来源: 题型:解答题
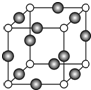 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.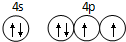 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
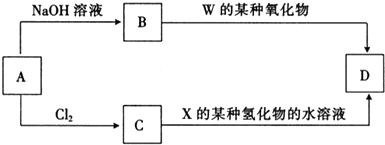
| W | X | ||
| Y | Z |
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
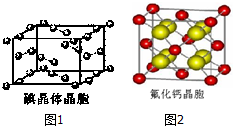 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
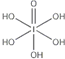 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| A. | M与T形成的化合物和强酸、强碱均能反应 | |
| B. | L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈 | |
| C. | Q元素在自然界中只能以化合态形式存在 | |
| D. | L与R两元素形成的化合物中,含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com