

 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是| A.改变反应条件可以改变该反应的限度 |
| B.达到平衡后,SO3、SO2、O2在密闭容器中共存 |
| C.达到平衡后,反应停止,正、逆反应速率都等于零 |
| D.SO3、SO2、O2的浓度保持不变,说明该可逆反应达到了平衡状态 |
科目:高中化学 来源:不详 题型:单选题
 3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在
3Z(g)。Z的含量(Z%)随时间t的变化如图所示。已知在 时刻改变了某一实验条件。下列判断正确的是
时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 | B.正反应是吸热反应 |
C. 时刻可能是增大了压强 时刻可能是增大了压强 | D. 时刻可能是降低了温度 时刻可能是降低了温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是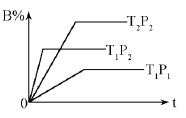
| A.T2>T1P1> P2 m+n > p Δ Η<0 |
| B.T1>T2P1< P2 m+n < p Δ Η>0 |
| C.T1<T2P1< P2 m+n < p Δ Η<0 |
| D.T1 >T2P1< P2 m+n > p Δ Η>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:| 容器编号 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4 |
| ② | 650 | 2 | 4 | | | t1 | Q1 |
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 |
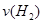 =__________。
=__________。 CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 、
、 与
与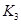 之间的关系,
之间的关系,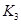 =______用
=______用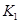 、
、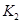 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻, 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。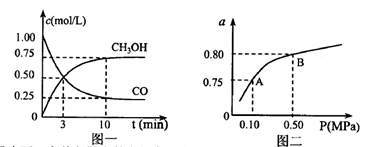
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
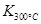 >
> ,则该反应是 热反应。
,则该反应是 热反应。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
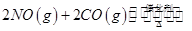
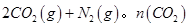 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题: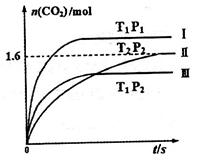
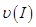 、
、 、
、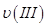 ,则三者大小关系为______________。
,则三者大小关系为______________。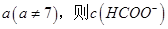 ________
________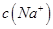 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。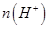 b.
b.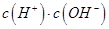 c.
c.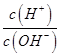 d.
d.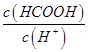
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
| B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>② |
| C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小 |
| D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com