
����Ŀ����ͼװ�ã���֪���缫�Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��a����Cu2����2e���� Cu b����Fe��2e���� Fe2����ش��������⣺

��1����װ���е������Һһ������_______ ������ţ�
A�� Cu2�� B��Na�� C��Fe2�� D�� Ag��
��2������װ����ԭ��أ���b��Ϊ_______ �����������������a���ĵ缫���Ͽ�����________���õ�ط�Ӧ���ܷ�Ӧ����ʽ��____________________��
����װ���ǵ��أ���a��Ϊ______ ������������������� ��a������������6.4gʱ����·��ͨ�����ӵ����ʵ���Ϊ________ mol��
���𰸡�A �� ���������ü�����ͭ����������ʯī�� Fe��Cu2����Fe2����Cu �� 0.2
��������
���缫�Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��a����Cu2����2e���� Cu ��a��������ԭ��Ӧ��b����Fe��2e���� Fe2����b������������Ӧ���ܷ�ӦΪCu2����Fe= Cu+ Fe2��������a���缫��Ӧʽ�����·��ͨ�����ӵ����ʵ�����
��1��a��������ӦΪCu2����2e���� Cu��������Һ��һ����Cu2������ѡA����2��a����Cu2����2e���� Cu ��a��������ԭ��Ӧ��b����Fe��2e���� Fe2����b������������Ӧ��ԭ�������������ԭ��Ӧ����������������Ӧ������װ����ԭ��أ���b��Ϊ������a��Ϊ�����������ĵ缫���Ͽ����DZ��������ü�����ͭ����������ʯī�ȣ�������Ӧ+������Ӧ���ܷ�Ӧ�����Ըõ�ط�Ӧ���ܷ�Ӧ����ʽ��Fe��Cu2����Fe2����Cu����������������������Ӧ������������ԭ��Ӧ������װ���ǵ��أ���a��Ϊ��������a������6.4gͭ�����ݵ缫��ӦCu2����2e���� Cu��ת�Ƶ������ʵ�����0.2mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯīϩ����������������ʯīϩ����͵缫֮����ٴ��������˶������Զ��з������Ϳɳ�ŵ��أ��䷴ӦʽΪLixC6+Li1-xCoO2![]() C6+LiCoO2���乤��ԭ������ͼ��ʾ�����й��ڸõ�ص�˵����ȷ���ǣ� ��
C6+LiCoO2���乤��ԭ������ͼ��ʾ�����й��ڸõ�ص�˵����ȷ���ǣ� ��

A. ���ʱ��![]() Ƕ��
Ƕ��![]() ��
��
B. �ŵ�ʱ��![]() �������ĵ缫��ӦΪ
�������ĵ缫��ӦΪ![]()
C. �ŵ�ʱ������ӦΪ��![]()
D. ���ʱ����ת��![]() ��ʯīϩ�缫����7g
��ʯīϩ�缫����7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���ĸ�ԭ���װ�ã����н�����ȷ����(����)

A. �٢���Mg��Ϊ�������ۢ���Fe��Ϊ����
B. ����Mg��Ϊ�������缫��ӦʽΪ6H2O��6e��===6OH����3H2��
C. ����Fe��Ϊ�������缫��ӦʽΪFe��2e��===Fe2��
D. ����Cu��Ϊ�������缫��ӦʽΪ2H����2e��===H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ̽��dz��ɫҺ��X���������ֳ���Ԫ�أ�����ɺ����ʣ���Ʋ��������ʵ�飺
 ��ش��������⣺
��ش��������⣺
��1��X�Ļ�ѧʽ��_________��
��2��X�ڹ���������ȼ�յĻ�ѧ����ʽ��_________��
��3����ҺC���ڵ���KI��ֽ�ϣ���ֽ����ɫ��д���ñ仯�з��������ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ������
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��_____________________��
��2����Ӧ��ʼ��2min����X��ʾ��ƽ����Ӧ����Ϊ____________________________��
��3����Ӧ��ʼ��2minʱ��Y��ת����Ϊ__________��
��4������������Ӧ���ı���������ʱ����Ӧ���ʻᷢ��ʲô�仯��ѡ���������С�����䡱����
�ٽ����¶ȣ�________
�ڱ���������������䣬����X�����ʵ�����________��
�۱���������������䣬����He��________��
�����������������________��
��5������������˵��������Ӧһ���ﵽ��ѧƽ��״̬����______������ţ�
A��X��Y��Z�����ʵ���֮��Ϊ3��1��2
B��X��Y��Z��Ũ�Ȳ��ٷ����仯
C����λʱ����ÿ����3mol X��ͬʱ����2mol Z
D��������������������ʱ��ı仯���仯
E�������е�ѹǿ���ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ����������У�������� �� ��
A.1mol �κ����ʶ�����6.02��1023������B.0.012kg12C�к���Լ6.02��1023��̼ԭ��
C.1mol H2O�к���2molH��1molOD.1mol C��Լ����3.612��1024������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ���û�ѧ�Լ�����ҵ�ϳ������̿���Ҫ�ɷ���MnO2��Ϊԭ�Ͻ����Ʊ�����Ҫ������������ͼ��
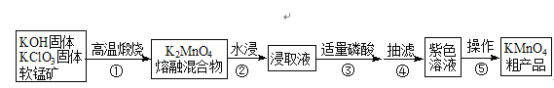
��֪��3K2MnO4+2H3PO4�T2KMnO4+MnO2��+2K2HPO4+2H2O
���� | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K�ܽ��/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
��1��ԭ�ϸ�������ʱѡ����������������������__________��
��2������ÿ����1molK2MnO4ʱ����ת��2mol��д����ѧ��Ӧ����ʽ_________��
��3���ӷ�Ӧ�����Ͳ������Ƕȿ��ǣ��ۿ������ᣬҲ��������________�Լ���
A������ B������ C������ D��CO2
��4��������������ȷ����_________��
A��������������������������������ȴ���壬���ȹ���
B������ʱ����©����ѡ�ô�С��С��©���ھ��Ҹ�סȫ��С����ֽ
C��������ˮ�Ҵ�ϴ�Ӳ�Ʒ��ߴ���
D��KMnO4����ĺ���¶ȹ��ή�Ͳ���
��5���ֲ�Ʒ��ϴ�Ӳ��������Ҫ�õ����²�����a������ϴ�Ӽ�����û���壻b��ϴ�Ӽ�����ͨ����c��ϴ�Ӽ�����ͨ����d����Сˮ��ͷ��e������ˮ��ͷ��f���ظ�2��3�Ρ�
��ѡ����ȷ�IJ���������________�����������ظ�ʹ�ã�
��6��������ز�Ʒ�Ĵ��Ȳⶨ��ȷ��ȡ0.7900g��Ʒ�����250mL��Һ����ȡ25.00mL����ƿ�У���0.1000molL��1��NH4��2Fe��SO4��2����Һ���еζ����ζ��յ������__________���ζ�ǰ�͵ζ����Һ�����ͼ�������������صĴ���Ϊ_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��һ�ֿ���ȱѪҩ��ϳ�·�����£�

��֪��

�ش��������⣺
(1)������E�Ľṹ��ʽ____________________��I�й����ŵ�����_____________��
(2)A��ϵͳ����__________________________��
(3)H��I�ķ�Ӧ����ʽ______________________________��
(4)A��B��E��F�ķ�Ӧ���ͷֱ���______________��Ӧ��_____________��Ӧ��
(5)д��A�����Ӿ۷�Ӧ�ķ�Ӧ����ʽ___________________________________��
(6)G��ͬ���칹���ж��֣�д����������������G������ͬ���칹��Ľṹ��ʽ_________________��
����FeCl3��Һ������ɫ��Ӧ���ں˴Ź���������4���
(7)a,a-�����д�![]() �Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ�a��a-�����д��ĺϳ�·�����£�
�Ǻϳ�ҽҩ��ũҩ���м��壬�Ա���2-�ȱ���Ϊ��ʼԭ���Ʊ�a��a-�����д��ĺϳ�·�����£�

��·�����Լ�������1Ϊ____________��X�Ľṹ��ʽΪ___________��Y�Ľṹ��ʽΪ____________���Լ�������2Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿�(��Ҫ�ɷ�ΪMnO2)�����̿�(��Ҫ�ɷ�ΪMnS)Ϊԭ���Ʊ������̾���Ĺ����������£�

(1)�����д���һ�ַǽ������ʣ�����������еĻ�ѧ����ʽΪ_________________________________��
(2)ʵ���ҳ���������ԭ���ⶨMnSO4��H2O����Ĵ��ȣ�ԭ�����£�2Mn2����NO3-��4PO43-��2H��===2[Mn(PO4)2]3����NO2-��H2O NH4+��NO2-===N2����2H2O [Mn(PO4)2]3����Fe2��===Mn2����[Fe(PO4)2]3������ȡMnSO4��H2O��Ʒ1.000 0 g����������ˮ������������λ���������������泥���220��240 ���³�ַ�Ӧ��Ȼ����N�������ڰ�����������ָʾ������0.100 0 mol��L��1��������隣���Һ�ζ����ɵ�[Mn(PO4)2]3�����յ㡣�ظ�����3�Σ���¼�������±���
�ζ����� | ��Һ����mL | |
�ζ�ǰ | �ζ��� | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
����֪��Fe2����NO2-��2H��===Fe3����NO����H2O��
�ⶨ�����У�����淋�������____________________��____________________��
�����ζ������б���Һ��������鱗��������õģ����ⶨ��MnSO4��H2O����Ĵ��Ƚ���________(����ƫ������ƫ��������������)��
�ۼ�����Ʒ��MnSO4��H2O����������(д���������)__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com