
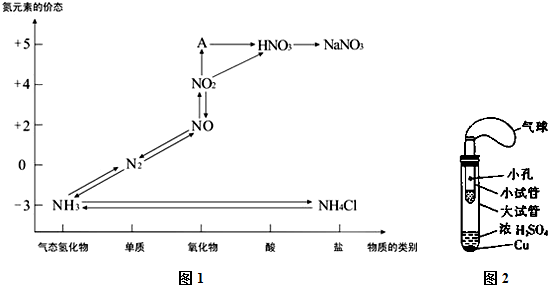
分析 (1)依据图中化合价与元素化合物之间关系可知A为+5价氧化物;所含元素化合价处于中间价态的既有氧化性又有还原性;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,铁与浓硝酸常温下发生钝化;
(3)①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
②依据二氧化硫的具有漂白性的特性检验二氧化硫的存在;
(4)二氧化硫与溴水反应生成溴化氢和硫酸.
解答 解:(1)依据图中化合价与元素化合物之间关系可知A为+5价氧化物,为N2O5;NO、NO2中氮元素处于中间价态,化合价既可以升高,又可以降低,所以既有氧化性又有还原性;
故答案为:N2O5;NO、NO2;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,铁与浓硝酸常温下发生钝化,所以可用浓硝酸除去铁制品表面的铜镀层,方程式:Cu+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+2NO2↑+2H2O;
故答案为:Cu+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+2NO2↑+2H2O;
(3))①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②二氧化硫的具有漂白性,能够使品红溶液褪色,所以可选择品红溶液检验二氧化硫的存在;
故选:C;
(4)二氧化硫与溴水反应生成溴化氢和硫酸,化学方程式:SO2+Br2+2H2O=H2SO4+2HBr;
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
点评 本题考查了元素化合物知识,涉及物质氧化性还原性判断,方程式的书写,明确物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醇可以与足量金属钠反应,生成0.5molH2,能证明乙醇分子有一个H原子与其余的H原子不同 | |
| B. | 下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化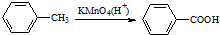 | |
| C. | 下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易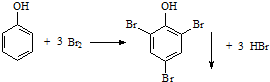 | |
| D. | 苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
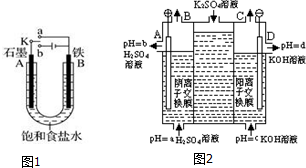
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | bd | B. | bc | C. | ad | D. | 只有d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com