
【题目】如图是100mg CaC2O4H2O受热分解时,所得固体产物的质量随温度变化的曲线.试利用图中信息结合所学的知识,回答下列各问题: 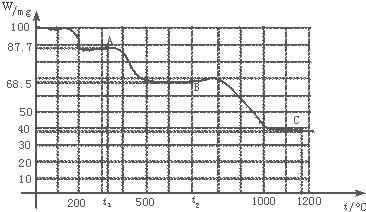
(1)温度分别为t1和t2时,固体产物的化学式A是 , B是 .
(2)由CaC2O4H2O得到A的化学方程式为 .
(3)由A得到B的化学方程式为 .
(4)由图计算产物C的相对分子质量,并推断C的合理的化学式.
【答案】
(1)CaC2O4; CaCO3
(2)CaC2O4?H2O ![]() CaC2O4+H2O↑
CaC2O4+H2O↑
(3)CaC2O4![]() CaCO3+CO↑
CaCO3+CO↑
(4)CaO
【解析】解:(1)设A、B的相对分子质量分别为x、y,则:由
CaC2O4H2O~~ | A |
146 | x |
100mg | 87.7mg |
所以x= ![]() =128,CaC2O4H2O相对分子质量为146,A与 CaC2O4H2O的相对分子质量相差18,则A为CaC2O4.由
=128,CaC2O4H2O相对分子质量为146,A与 CaC2O4H2O的相对分子质量相差18,则A为CaC2O4.由
CaC2O4H2O~~ | B |
146 | y |
100mg | 68.5mg |
y= ![]() =100 mg,则B为CaCO3.
=100 mg,则B为CaCO3.
故答案为:CaC2O4;CaCO3.(2)A为CaC2O4,CaC2O4H2O分解生成CaC2O4与H2O,该温度下,水为气态,反应方程式为CaC2O4H2O ![]() CaC2O4+H2O↑.
CaC2O4+H2O↑.
故答案为:CaC2O4H2O ![]() CaC2O4+H2O↑.(3)A为CaC2O4,B为CaCO3,所以CaC2O4分解生成CaCO3与CO,反应方程式为CaC2O4
CaC2O4+H2O↑.(3)A为CaC2O4,B为CaCO3,所以CaC2O4分解生成CaCO3与CO,反应方程式为CaC2O4 ![]() CaCO3+CO↑.
CaCO3+CO↑.
故答案为:CaC2O4 ![]() CaCO3+CO↑.(4)当加热至1100℃~1200℃时,由图读得分解产物C的质量约为38mg,
CaCO3+CO↑.(4)当加热至1100℃~1200℃时,由图读得分解产物C的质量约为38mg,
C的相对分子质量为 ![]() ×146=55.48,C相对分子质量的实验值与CaO的相对分子质量56接近,故C为CaO.
×146=55.48,C相对分子质量的实验值与CaO的相对分子质量56接近,故C为CaO.
答:C的相对分子质量为55.48,C的化学式为CaO.
由图可知:t1时产物A的质量为87.7 g,t2时,B为68.5 g.观察化学式:CaC2O4H2O,其逐步分解的固体产物必为含Ca的化合物,则产物A、B、C的物质的量应与CaC2O4H2O相同.(1)设A、B的相对分子质量分别为x、y,根据关系式计算A、B的相对分子质量,据此判断A、B的化学式.(2)根据A的化学式判断其它产物,书写方程式.(3)根据A、B的化学式判断其它产物,书写方程式.(4)由图可知产物C的质量约为38 mg,C的物质的量应与CaC2O4H2O相同,根据由化学式计算质量分数,计算C的相对分子质量,据此判断C的化学式.


科目:高中化学 来源: 题型:
【题目】检验某未知溶液中是否含有SO42-的下列操作中,最合理的是()
A.先加硝酸酸化,再加氯化钡溶液B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液D.先加盐酸酸化,再加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验不能达到目的是( )
A.采用如图所示的装置制取少量的氢氧化亚铁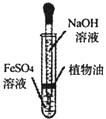
B.加热苯、液溴和浓硫酸的混合物制取少量的溴苯
C.用碎瓷片作催化剂进行石蜡油的受热分解实验
D.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中有浓度均为0.01molL﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38;Ksp[Cr(OH)3]=7.0×10﹣31 , Ksp[Zn(OH)2]=1.0×10﹣17;Ksp[Mg(OH)2]=1.8×10﹣11 . 当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
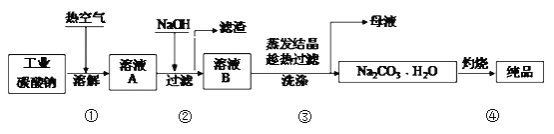
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com