
【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。

①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,

①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
【答案】2Cl-+ 2H2O![]() 2OH-+H2↑+ Cl2↑ H+得电子生成H2,H+浓度减小,促使水的电离平衡向着电离方向移动,OH-浓度增大 Mg(OH)2 b NaOH 12 正 H2-2e-+2OH-=2H2O 锌 CuSO4 Cu-2e-= Cu2+ 稀H2SO4 H2O+HSO3--2e-= SO42-+3H+ 阴极室H+放电,产生OH-,OH-和HSO3-反应,生成SO32-,Na+通过阳离子交换膜进入阴极室,Na2SO3溶液吸收SO2,又得到Na2SO3和NaHSO3的混合溶液,实现循环利用和再生
2OH-+H2↑+ Cl2↑ H+得电子生成H2,H+浓度减小,促使水的电离平衡向着电离方向移动,OH-浓度增大 Mg(OH)2 b NaOH 12 正 H2-2e-+2OH-=2H2O 锌 CuSO4 Cu-2e-= Cu2+ 稀H2SO4 H2O+HSO3--2e-= SO42-+3H+ 阴极室H+放电,产生OH-,OH-和HSO3-反应,生成SO32-,Na+通过阳离子交换膜进入阴极室,Na2SO3溶液吸收SO2,又得到Na2SO3和NaHSO3的混合溶液,实现循环利用和再生
【解析】
氯化钠溶液中含Na+、Cl-、H+、OH-,根据放电顺序Cl-、H+优先失电子分析产物,书写离子方程式,也因为H+减少会引起水的电离平衡向着电离方向移动,OH-浓度增大,阴极区碱性增强,进而除去Ca2+、Mg2+,则阴极室a出口为NaOH,因电解池中阳离子移向阴极,阴离子移向阳极,则淡水出口为b,原电池电解池组合电路中整个电路中转移的电子数目相同,得出关系式进行计算;组合电路中b与电源负极相连,为阴极,得电子,a与电源正极相连,为阳极,失电子,根据题目给出信息判断得失电子情况,确定其位置进行作答;吸收液再生循环原理根据电解池工作原理,结合图示进行分析。
(1)①氯化钠溶液中含Na+、Cl-、H+、OH-,电解时阳极Cl-失电子生成Cl2,阴极H+得电子生成H2,电解氯化钠溶液的离子方程式为:2Cl-+ 2H2O![]() 2OH-+H2↑+ Cl2↑;
2OH-+H2↑+ Cl2↑;
②由①可知,电解过程中阴极H+得电子生成H2,导致溶液中H+浓度减小,促使水的电离平衡向着电离方向移动,溶液中OH-浓度增大,碱性增强;因为OH-浓度增大,会与Mg2+生成Mg(OH)2白色沉淀,同时还能与HCO3-反应生成CO32-,CO32-与Ca2+生成CaCO3,故阴极附近产生的白色沉淀有Mg(OH)2和CaCO3;
③电解池中,阳离子移向阴极,阴离子移向阳极,则淡水出口为b,Ca2+、Mg2+在阴极生成沉淀被除去,故a出口的物质为NaOH;
④当电池消耗0.00025molO2时,根据得失电子守恒和化学计量数得出关系:
O2~4e-~2H2~4NaOH,则生成n(NaOH)= 0.00025mol×4=0.001mol, c(OH-)= c(NaOH)= 0.001mol/0.1L=0.01 mol/L,常温下c(H+)=KW/ c(OH-)=10-12 mol/L, pH=12;
(2)①氢氧燃料电池,O2得电子,从正极通入,H2失电子,从负极通入,电解质溶液为KOH溶液,故电极反应式为H2-2e-+2OH-=2H2O;
②锌片上镀铜,则锌被保护,为阴极,铜被消耗,为阳极,b与电源负极相连,为阴极,故b的电极材料是锌,Cu2+得电子,N溶液为CuSO4溶液;
③a与电源正极相连,为阳极,Cu+H2SO4= CuSO4+H2↑,Cu失去电子作阳极,电极反应式为:Cu-2e-= Cu2+,N溶液为稀H2SO4;
(3)①由图可知,HSO3-在阳极失电子得到SO42-,故电极反应式为HSO3--2e-= SO42-+H+;
②阴极H+得电子生成H2,OH-浓度增大,Na+通过阳离子交换膜进入阴极室,则阴极室产生的物质为NaOH,NaOH用于吸收SO2,得到Na2SO3和NaHSO3,将混合溶液进行电解,又可以得到NaOH吸收液,实现循环利用和再生。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是( )
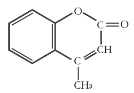
A.1 mol该物质最多能和5mol H2发生加成反应
B.能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C.该分子中所有原子都可能共平面
D.该物质的分子式为C10H10O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,滴定曲线如图,下列有关说法正确的是( )

A.指示剂变色时,说明反应的酸、碱恰好等物质的量反应
B.当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6J的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(![]() )< c(H2CO3)
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是 ![]() 水解被促进产生的
水解被促进产生的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)下列过程不一定释放能量的是________。
A. 化合反应 B. 分解反应 C. 形成化学键 D. 燃料燃烧 E. 酸碱中和 F. 炸药爆炸
(2)等质量的下列物质分别完全燃烧生成![]() ,放出热量较多的是________。
,放出热量较多的是________。
A. 硫蒸气 B. 硫固体
(3)已知:通常条件下,强酸强碱稀溶液中和生成![]() 水放出的热量为中和热。稀溶液中
水放出的热量为中和热。稀溶液中![]() 和
和![]() 恰好完全反应时放出
恰好完全反应时放出![]() 热量,则其中和热为________
热量,则其中和热为________![]() 。
。
(4)已知![]() 和
和![]() 反应生成
反应生成![]() 是放热反应,且断开
是放热反应,且断开![]() 键、
键、![]() 键、
键、![]() 键需吸收的能量分别为
键需吸收的能量分别为![]() 、
、![]() 、
、![]() 。由此可以推知下列关系正确的是________(填序号)。
。由此可以推知下列关系正确的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]()
D. ![]() E.
E. ![]() F.
F. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学过程及其表述正确的是( )
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3mol/L的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++ H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)

(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.由图甲可以判断:若T1>T2,反应A(g)+ B(g)![]() 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富铁铝土矿![]() 主要含有
主要含有![]() 、
、![]() 、FeO和
、FeO和![]() 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁![]() 研究发现,当
研究发现,当![]() 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下![]() 部分操作和产物略
部分操作和产物略![]() :
:
![]()
![]() 与
与![]() 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
![]() 测得滤液中
测得滤液中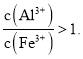 加入
加入![]() 和
和![]() 的作用是
的作用是![]() 结合化学用语说明
结合化学用语说明![]() ______ .
______ .
![]() 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示![]() 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极![]()
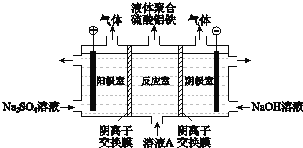
![]() 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
![]() 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com