
向某恒容密闭容器中充入一定量C02和H2,发生反应: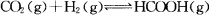 测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是
测得平衡体系中C02的百分含量(C02%)与反应温度变化的关系如图所示。下列物理量 中,a点大于b点的是

①:正反应速率 ②逆反应速率 ③HCOOH(g)的浓度 ④对应温度时的平衡常数
A. ①② B.①③ C.②④ D.③④
科目:高中化学 来源:2016届河南省三门峡市高三上学期第二次精英对抗赛化学试卷(解析版) 题型:填空题
已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
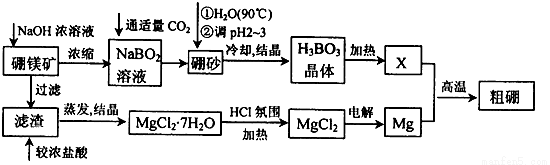
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______。当溶液pH=6时, (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次月考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中进行某化学反应,其平衡常数表达式为K=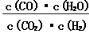 。
。
化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学方程式为 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
查看答案和解析>>
科目:高中化学 来源:2016届河南省三门峡市高三上学期第二次精英对抗赛化学试卷(解析版) 题型:选择题
下列化学反应先后顺序判断正确的是
A、在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、AI3+、AI (OH )3,
B、在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I一、Br一、Fe2+
C、在含有等物质的量的NaCl、Na2S的溶液中加入AgNO3溶液:NaCl、Na2S
D、在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:填空题
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0

(1)某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“= ”,下同)SO3浓度c(a) c(b) c点,反应速率υ(正) υ(逆)。
”,下同)SO3浓度c(a) c(b) c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:选择题
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
A. 增大反应体系的压强,反应速率可能加快
B. 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C. 电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D. 将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:选择题
下列各项操作中,能发生“先沉淀后溶解”现象的是
①向BaCl2溶液中通入过量的SO2
②向Fe(OH)3胶体中逐滴滴入过量稀H2SO4
③向Na[Al(OH)4]溶液中逐滴加入过量的AlCl3溶液
④向澄清石灰水中通入过量的SO2
⑤向硅酸钠溶液中通入过量的CO2
⑥向AgNO3溶液中逐滴加入过量的氨水.
A.②④⑥ B.①②④ C.①③⑤⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月半月考试化学试卷 (解析版) 题型:选择题
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:
2MnO4-+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是
A.Na2O2既是氧化剂,又是还原剂
B.O2是还原产物,Mn2+是氧化产物
C.通常用浓盐酸酸化高锰酸钾溶液
D.标准状况下,产生22.4 L O2时反应转移2 mol e-
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期期中化学试卷(解析版) 题型:选择题
利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com