
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
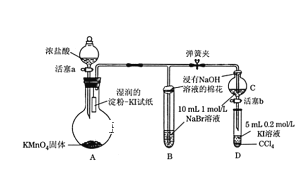
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_________。实验室在加热条件下制取该气体的离子方程式为____________。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为__________________________
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应为Cl2+2NaBr=2NaCl+Br2,以此说明C中________,从而得出D中氧化I-的氧化剂必为_______,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为______________,发生反应的离子方程式为_____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
【答案】![]() MnO2+4H++2Cl-
MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 氢氧化钠溶液 无Cl2,排除Cl2对溴置换碘实验的干扰 Br2 CCl4层溶液变为紫红色 Br2+2I-=I2+2Br - 原子半径逐渐增大
Mn2++Cl2↑+2H2O 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 氢氧化钠溶液 无Cl2,排除Cl2对溴置换碘实验的干扰 Br2 CCl4层溶液变为紫红色 Br2+2I-=I2+2Br - 原子半径逐渐增大
【解析】
装置A中高锰酸钾固体与浓盐酸反应生成氯化锰、氯化钾、氯气和水,反应生成的氯气使湿润的淀粉KI试纸变蓝;装置B、C中氯气与溴化钠溶液发生置换反应生成氯化钠和单质溴,浸有氢氧化钠溶液棉花吸收有毒的氯气,防止污染环境;装置D中反应生成的单质溴与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,震荡,静置,溶液分层,下层溶液变为紫红色,该实验说明氯、溴、碘单质的氧化性逐渐减弱。
(1)A中产生黄绿色气体为氯气,氯气是双原子分子,电子式为![]() ;实验室用二氧化锰与浓盐酸共热反应制备氯气,反应的离子方程式为MnO2+4H++2Cl-
;实验室用二氧化锰与浓盐酸共热反应制备氯气,反应的离子方程式为MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,故答案为:
Mn2++Cl2↑+2H2O,故答案为:![]() ;MnO2+4H++2Cl-
;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置A中反应生成的氯气使湿润的淀粉KI试纸变蓝,说明氯气与碘化钾发生置换反应生成单质碘和氯化钾,由氧化剂的氧化性大于氧化产物的氧化性可知Cl2的氧化性大于I2的氧化性,故答案为:湿润的淀粉KI试纸变蓝;
(3)装置C中氯气与溴化钠溶液发生置换反应生成氯化钠和单质溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(4)氯气能与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,若试管B的作用就是吸收氯气,防止多余Cl2污染空气,则最佳试剂为氢氧化钠溶液;为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,关闭活塞a,则C中无Cl2,排除了Cl2对溴置换碘实验的干扰;由此可知装置D中反应生成的单质溴做氧化剂,与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,故答案为:氢氧化钠溶液;无Cl2,排除Cl2对溴置换碘实验的干扰;Br2;
(5)装置D中反应生成的单质溴与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,震荡,静置,溶液分层,下层溶液变为紫红色,反应的离子方程式为Br2+2I-=I2+2Br -,故答案为:CCl4层溶液变为紫红色;Br2+2I-=I2+2Br -;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,故答案为:原子半径逐渐增大。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_____________。
(2)反应③的化学方程式是_________________________________。
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式是___________。
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。A制备F的化学方程式是_____________。
(5)B与D反应加入浓硫酸的作用是_________;为了得到较纯的E,需除去E中含有的D,最好的处理方法是_____________(用序号填写)。
a.蒸馏 b.用过量饱和碳酸钠溶液洗涤后分液 c.水洗后分液 d.用过量氯化钠溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
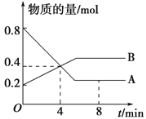
(1)该反应的化学方程式为___________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
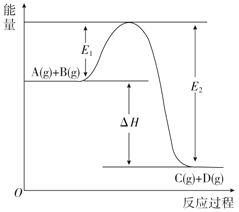
【题目】反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是_____反应(填“吸热”或“放热”),
(2)E1表示____________,E2表示_____, △H=______,
(3)反应体系中加入催化剂对反应热是否有影响?_______(填“有影响”“无影响”),
(4)在反应体系中加入催化剂,E1和E2的变化是:E1____,E2____(填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: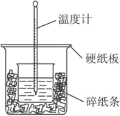
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 ________________________
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50mol·L-1的盐酸跟60 mL 0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
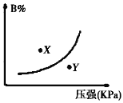
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com