
| A. | 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的原子序数一定是X<Y | |
| B. | 共价化合物的熔沸点都比较低 | |
| C. | 热稳定性:AsH3<PH3<H2O<HF | |
| D. | 最外层电子数较少的金属元素,不一定比最外层电子数较多的金属元素活泼性强 |
分析 A.短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则X在Y的下一周期;
B.共价化合物可能为原子晶体;
C.非金属性越强,对应氢化物越稳定;
D.最外层电子数较少的金属元素,同主族电子层越多,越易失去电子.
解答 解:A.短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则X在Y的下一周期,则两元素的原子序数一定是X>Y,故A错误;
B.共价化合物可能为原子晶体,如二氧化硅具有较高的熔沸点,故B错误;
C.非金属性越强,对应氢化物越稳定,则热稳定性:AsH3<PH3<H2O<HF,故C正确;
D.最外层电子数较少的金属元素,同主族时电子层越多,越易失去电子,则最外层电子数较少的金属元素,不一定比最外层电子数较多的金属元素活泼性强,如Ca比Li活泼,故D正确;
故选CD.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律及特例为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
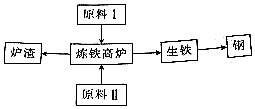
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨⑩ | B. | ②③④⑦⑨⑩ | C. | ①③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 实验室制二氧化碳 | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 工业上电解熔融状态Al2O3制备Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积.起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O |
| B | Mg2+、Cl-、HCO3- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| C | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+═SO2↑+H2O |
| D | K+、CO32-、NH3•H2O | 通入少量CO2 | CO32-+CO2+2H2O═2HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com