
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155 |
| A. | -485kj/mol | B. | +485kj/mol | C. | +l940kj/mol | D. | -l940kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | Na2CO3溶液中滴加酚酞呈红色,加热红色变浅 | |
| C. | 0.1mol•L-1的Na2CO3溶液中c(Na+)>2c(CO32-) | |
| D. | 相同温度下,CaCO3在饱和Na2CO3溶液中的KSP比在纯水中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Cs Rb K Na Li | B. | 溶解度:NaHC03 Na2C03 CaC03 | ||
| C. | 氧化性:Li+Na+K+ Rb+Cs+ | D. | 碱性:LiOH NaOH KOH RbOH CsOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自发进行的反应一定时放热反应 | B. | 非自发进行的反应一定是吸热反应 | ||
| C. | 自发进行的反应一定能发生 | D. | 有些吸热反应也能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
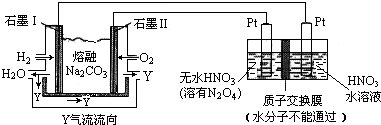
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com