
| A. | CH4分子的比例模型: | B. | 羟基的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的分子式:CH3CH2OH |
分析 A.甲烷为正四面体结构,根据甲烷的比例模型、球棍模型的表示方法进行判断;
B.羟基中O原子最外层得到8电子稳定结构;
C.乙烯的结构简式中没有标出官能团碳碳双键;
D.分子式中不需要标出官能团.
解答 解:A.甲烷分子中含有1个C、4个H原子,为正四面体结构,碳原子的相对体积大于氢原子,甲烷的比例模型为: ,故A正确;
,故A正确;
B.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为 ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.乙醇的分子中含有2个C、6个H和1个O原子,乙醇的分子式为C2H6O,故D错误;
故选A.
点评 本题考查了电子式、比例模型、结构简式、分子式等知识,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确分子式与结构简式、比例模型与球棍模型的区别,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | NA个H2SO4分子的质量与H3PO4的摩尔质量相等 | |
| D. | 标准状况下,2.24L水所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤① | B. | ①②③④ | C. | ④②⑤③ | D. | ⑥③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰升华和液氯气化时要破坏不同的微粒间作用力 | |
| B. | CO2和SiO2具有相同的化学键类型和晶体类型 | |
| C. | 水结成冰体积膨胀、密度变小,这一事实与水分子间存在氢键有关 | |
| D. | 盐酸能电离出氢离子和氯离子,所以HCl中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
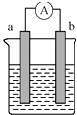 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )| A. | 上述反应的△H<0 | B. | 压强P1<P2<P3<P4 | ||
| C. | 1100℃该反应的平衡常数为64 | D. | 压强为P4时,在Y点:v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com