
分析 (1)醋酸为弱酸,等pH时醋酸的浓度较大;
(2)①由硫酸溶液pH=5,计算原溶液中c(H+),原溶液中c(SO42-)=$\frac{1}{2}$c(H+),稀释1000倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度;
②体积为Va、pH=13的NaOH溶液与体积Vb、pH=1的H2SO4溶液混合,恰好中和,则:Va•10-1=Vb•10-1;
计算n(H+)、n(OH-),反应后pH=2,计算出反应后c(H+)与体积的关系,可确定Va:Vb.
解答 解:(1)醋酸为弱酸,等pH时醋酸的浓度较大,与锌反应时醋酸的速率大,则生成等体积的氢气,盐酸反应的时间较长,完全中和等物质的量的NaOH溶液,需要醋酸的体积较小,
故答案为:>;>;
(2)①pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-5mol/L=5×10-6mol/L;
溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×$\frac{1}{1000}$=5×10-9mol/L,
所以稀释后溶液中c(H+):c(SO42-)=1×10-7mol/L:5×10-9mol/L=20:1,
故答案为:20:1;
②pH=13的NaOH溶液中c(OH-)=0.1mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,若所得混合液为中性,则Va•0.1=Vb•0.1,Va:Vb=1:1,
若所得混合液pH=2,则$\frac{0.1{V}_{b}-0.1{V}_{a}}{{V}_{a}+{V}_{b}}$=0.01,Va:Vb=9:11,
故答案为:1:1;9:11.
点评 本题考查酸碱混合的定性判断和溶液PH的有关计算,侧重于学生的分析、计算能力的考查,题目难度中等,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH-)的关系.


科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
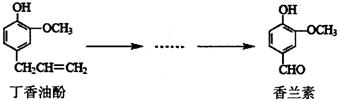 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )| A. | 在丁香油酚分子中至少有12个原子共平面 | |
| B. | 常温下,1mol丁香油酚可与2molBr2反应 | |
| C. | 1moI香兰素最多能与4mol氢气发生加成反应 | |
| D. | 可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
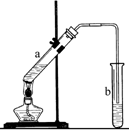
 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.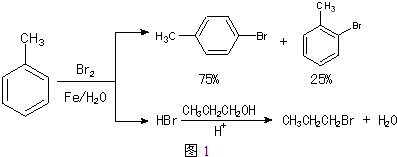
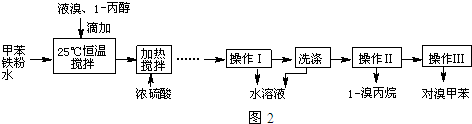
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
 .
.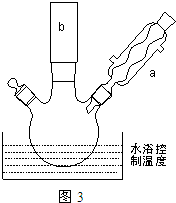 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C2H4O | C. | C2H6 | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为
有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为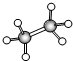 ;C的比例模型为
;C的比例模型为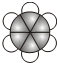 ;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的化合物溶于水后溶液呈碱性 | |
| B. | 简单离子半径:W<X<Z | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ②⑤⑥ | C. | ①⑤⑦ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B元素基态原子的电子排布图为
,B元素基态原子的电子排布图为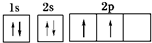 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com