
100℃时,在1L恒温恒容的密闭容器中,通入0.1
mol N2O4,发生反应:N2O4(g)
 2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
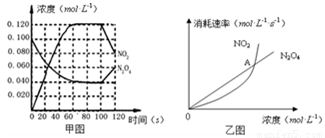
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1 。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1= =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2 ,则k1 k2 (填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为 。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H= +67.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534.7 kJ·mol-1
N2O4(g)  2NO2(g)
△H= +57.0 kJ·mol-1
2NO2(g)
△H= +57.0 kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
(1)、10-3 (2分); (2)、c2 NO2/ c N2O4(或0.122/0.04)(2分),<(2分)
(3)、A (4分) (4)、B(3分) (5)、-1079.6 (3分,未写“-”号扣1分)
【解析】
试题分析: (1)由甲图可知,在60s时,N2O4的浓度为0.04 mol·L-1 ,所以以N2O4表示的平均反应速率为v=(0.1-0.04) mol·L-1÷60s=0.001 mol·L-1·s-1 。
(2)甲图可知在反应到60s时,反应物和生成物的浓度保持不变,所以此时反应达平衡,平衡常数K1=c2(NO2)/ c(N2O4)=0.122/0.04=0.36mol.L-1.S-1 ;因为该反应的焓变△H>0,所以是个放热反应,所以升高温度,平衡正向移动,平衡常数增大,k1<k2 。
(3)从图像上来看,100s时,反应物浓度增大,生成物浓度减小,说明平衡逆向移动,所以这一改变的条件可能是降低温度,平衡逆向移动了,A正确;通入不反应的惰性气体对反应无影响,B错误;反应物和生成物的变化量之比为1:2,所以不是改变反应物和生成物的量,C错误;增大容器的体积,系统压强减小,各物质的浓度瞬间改变,且平衡正向移动,所以D错误;故选A。
(4)乙图中交点A表明此刻v(NO2)消耗= v(N2O4)消耗,但v(NO2)生成= 2v(N2O4)消耗,所以v(NO2)生成>v(NO2)消耗,所以反应正向进行,故选B。
(5)根据热化学方程式和盖斯定律可知,所求方程式=2×②+③-①,所以△H=2×△H2 +△H3-△H1=-1079.6 kJ·mol-1 。
考点:本题考查的是化学反应速率、化学平衡、化学反应与能量的知识点。


科目:高中化学 来源: 题型:
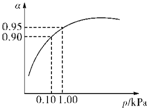 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| 太阳光 |
| ||
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
利用光能和光催化剂,可将CO2和H2O转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下左图所示。


(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,一定温度下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
CO(g)+3H2(g) K=27mol2·L-2。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,在上述温度下发生反应达到平衡,测得CO的物质的量为0.10mol,CH4的平衡转化率为 (保留两位有效数字)。
(3)甲烷燃料电池是利用CH4跟氧气或空气反应将化学能转化成电能的装置,电解质溶液是强碱。下面有关说法正确的是 (填编号)。
A.负极反应为:O2+2H2O+4e- -→4OH-;
B.负极反应为:CH4+10OH- - 8e--→CO32-+7H2O
C.放电时溶液中的阴离子向负极移动
D.随放电的进行,溶液的pH值不变
(4)如上右图是一个电化学装置示意图,甲烷燃料电池作其电源。
①如果A为含有铁、银、金、碳杂质的粗铜,B为纯铜,C为CuSO4溶液,通电后,Cu2+的浓度将 (填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是KBr溶液,通电时阳极的电极反应式是__________________________。
③特定条件下,该装置使用惰性电极电解Na2SO4浓溶液可制得少量过氧化氢:在阳极上SO![]() 被氧化成S2O
被氧化成S2O![]() (过二硫酸根离子),S2O
(过二硫酸根离子),S2O![]() 与H2O反应即可生成H2O2,
与H2O反应即可生成H2O2,
S2O![]() +2H2O === 2SO
+2H2O === 2SO![]() +H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
+H2O2+2H+。若各反应物质的转化率均为100%,则要制取1 mol H2O2,理论上燃料电池需消耗CH4的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
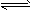 2NO2(g) 的平衡常数为_______,N2O4的转化率为______。
2NO2(g) 的平衡常数为_______,N2O4的转化率为______。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com