
| A、浓硝酸和氯水用棕色试剂瓶保存 |
| B、硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C、常温下铁和铂都不溶于浓硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C、升高温度,CaCO3沉淀的溶解度无影响 |
| D、向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
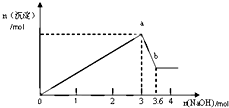
| 1 |
| 2 |
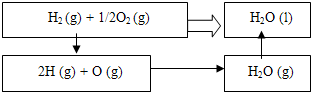
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 在一定条件下可水解为
在一定条件下可水解为 和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为
和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、碳原子中的质子数为6 |
| B、碳的相对原子质量是12.01g |
| C、碳属于金属元素 |
| D、碳的氧化物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg)2+大 |
| B、25°C时,固体在20ml0.01 mol?L-1氨水中的比20mL0.01 mol?L-1NH4Cl溶液中的KSP小 |
| C、25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,C(Mg2+)增大 |
| D、25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com